Kémiai kötés
Az anyag legkisebb része az atomok kölcsönhatásának eredményeként létrejött molekula, amely között kémiai kötések vagy kémiai kötések játszanak szerepet. A kémiai kötés tana képezi az elméleti kémia alapját. Kémiai kötés akkor fordul elő, ha két (néha több) atom kölcsönhatásba lép. A kommunikáció kialakulása az energiafelszabadulással történik.
A kémiai kötés olyan kölcsönhatás, amely az egyes atomokat molekulákhoz, ionokhoz, kristályokhoz kapcsolja.
A kémiai kötés természeténél fogva egységes: elektrosztatikus eredetű. De számos kémiai vegyület esetében a kémiai kötés eltérő; a kémiai kötés legfontosabb típusa kovalens (nempoláris, poláris), ionos és fémes. Az ilyen típusú kötések fajtái a donor-akceptor, a hidrogén stb. Fém-atomok keletkeznek.
A kémiai kötést, amelyet egy közös vagy elválasztott párt vagy több pár elektron létrehozásával valósítanak meg, kovalensnek nevezik. Az egyik közös elektronpár létrehozásakor minden egyes atom egy elektront, azaz egy részt vesz "egyenlő arányban" (Lewis, 1916). Az alábbiakban bemutatjuk a H2, F2, NH3 és CH4 molekulák kémiai kötésének képződését. A különböző atomokba tartozó elektronokat különböző szimbólumok jelzik.
A kémiai kötések kialakulásának eredményeképpen a molekula mindegyik atomja stabil két- és nyolc-elektron konfigurációval rendelkezik.
Amikor kovalens kötés következik be, az elektron-felhők az atomokba átfedik egymást, így egy molekuláris elektronfelhő jön létre, amelyet energia-nyereség kísér. A molekuláris elektronfelhő a két mag középpontjai között helyezkedik el, és növekszik az elektronsűrűség az atomelektron felhő sűrűségéhez viszonyítva.
A kovalens kötés csak akkor lehetséges, ha a különböző atomok párosítatlan elektronjainak párhuzamosan kapcsolódnak. Az elektronok párhuzamos pörgetésével az atomok nem vonzódnak, de megtagadják: a kovalens kötés nem valósul meg. A kémiai kötés leírására szolgáló eljárást, amelynek kialakulását egy közös elektronikus párhoz kapcsolják, az úgynevezett valencia kötés (MVS) módszer.
A MIF főbb rendelkezései
Kovalens kémiai kötést alakítanak ki két ellentétes irányú pörgetett elektron, és ez az elektronpár két atomhoz tartozik.
A kovalens kötés annál erősebb, annál inkább átfedi a kölcsönhatásba lépő elektronfelhőket.
A strukturális képletek írása során a kapcsolatot létrehozó elektronikus párbeszédeket gyakran kötőjellel ábrázolják (a szocializált elektronokat képviselő pontok helyett).
Fontos a kémiai kötés energia jellemzője. Amikor létrejön a kémiai kötés, a rendszer (molekula) teljes energiája kisebb, mint az alkotó részek (atomok) energiája, azaz EAB<ЕА+ЕB.
A Valence egy kémiai elem atomjának tulajdonában van ahhoz, hogy egy másik elem atomjai egy bizonyos számú atomját csatolják vagy helyettesítsék. Ebből a szempontból az atom valenciáját legegyszerűbben a hidrogénatomok száma határozza meg, amelyek vele kémiai kötéseket alkotnak, vagy az elem atomjával felváltott hidrogénatomok száma.
Az atomra vonatkozó kvantummechanikai elképzelésekkel a valenciát a kémiai kötések kialakulásában résztvevő párosítatlan elektronok száma határozta meg. A párosítatlan elektronok mellett az atom vegyértékessége függ a valence elektronréteg üres és teljesen töltött orbitáljától.
A kötési energia az a energia, amelyet felszabadítanak, amikor egy molekulát atomokból alakítanak ki. A kötési energiát általában kJ / mol (vagy kcal / mol) formájában fejezzük ki. Ez a kémiai kötés egyik legfontosabb jellemzője. A stabilabb rendszer kevesebb energiát tartalmaz. Például ismeretes, hogy a hidrogénatomok általában egy molekulához kötődnek. Ez azt jelenti, hogy a H2 molekulákból álló rendszer kevesebb energiát tartalmaz, mint az azonos számú H atomból álló rendszer, de nem kapcsolódik molekulákká.
Ábra. 2.1 A két hidrogénatom rendszerének potenciális energia E függése a belső nukleáris távolságon r: 1 - kémiai kötés kialakulása után; 2 - kialakulása nélkül.
A 2.1. Ábra mutatja a kölcsönható hidrogénatomokra jellemző energia-görbét. Az atomok konvergenciáját az energia felszabadulása kísérte, amely annál inkább átfedi az elektronikus felhőket. Mindazonáltal rendes körülmények között, a Coulomb repulzió miatt, lehetetlen elérni a két atom magjainak fúzióját. Ezért bizonyos távolságon belül az atomok vonzereje ellenére megszólalnak. Így az r0 atomok közötti távolság, amely megfelel az energia-görbe minimumának, megegyezik a kémiai kötés hosszával (1. görbe). Ha az egymással kölcsönható hidrogénatomok elektronpólusai ugyanazok, akkor visszafojtásuk megtörténik (2. görbe). A különböző atomok kötési energiája 170-420 kJ / mol (40-100 kcal / mol) tartományonként változik.
Az elektron átalakulási folyamata egy magasabb energiaszinthez vagy szinthez (vagyis a korábban említett gerjesztés vagy párosítás folyamatához) energiaköltséget igényel. Ha kémiai kötést képez, az energia felszabadul. Annak érdekében, hogy a kémiai kötés stabil legyen, szükséges, hogy a gerjesztés következtében az atom energiájának növekedése kisebb legyen, mint a keletkező kémiai kötés energiája. Más szavakkal, szükséges, hogy az atomok gerjesztésére fordított energiaköltséget kompenzálják az energia felszabadulása a kötés kialakulása miatt.
A kötési energia mellett a kémiai kötést a hossz, a sokféleség és a polaritás jellemzi. Egy két molekulát tartalmazó molekulánál a kötések és a molekula egészének polaritása közötti szögek fontosak.
A kötés sokaságát a két atomot összekötő elektronpárok száma határozza meg. Így a H3C-CH3 etánban a szénatomok közötti kötés egyetlen, etilén H2C = CH2-kettős, acetilén HC0CH-hármasban van. A kötés sokféleségének növekedésével a kötési energia növekszik: a C-C kötési energiája 339 kJ / mol, C = C-611 kJ / mol és CºC-833 kJ / mol.
Az atomok közötti kémiai kötés az elektronfelhők átfedése miatt következik be. Ha az atomok magjait összekötő vonal mentén átfedés történik, akkor az ilyen kapcsolatot sigma-kötésnek (# 963; -link) nevezzük. Két s-elektron, s- és p-elektron, két px-elektron, s és d elektron lehet (például):
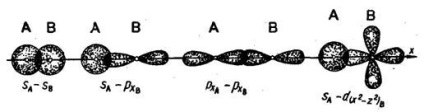
A kémiai kötést, amelyet egy elektronikus párral végzünk, egyszemélyesnek nevezzük. Egyetlen kapcsolat - mindig # 963; -csatlakozás. Az s típusú orbitálok csak formázhatnak # 963; kommunikáció.
Két atom kötése egynél több elektronpárral valósítható meg. Az ilyen kapcsolatot többszörösnek nevezik. A többszörös kötés kialakulásának egyik példája a nitrogén molekula. A nitrogénmolekulában a px orbitálisok képezik az egyiket # 963; -csatlakozás. Ha a pz-orbitálisok egy kötést alkotnak, két régió keletkezik
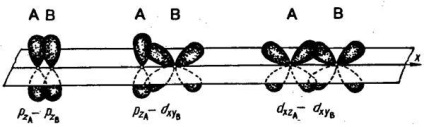
Az ilyen kapcsolatot pi-kapcsolatnak (π-link) nevezik. Két atom közötti π-kötés megjelenése csak akkor következik be, ha már kapcsolódtak egymáshoz # 963; -csatlakozás. A nitrogénmolekula második π-kötését az atomok orbitális atomjai alkotják. A π-kötések kialakulásakor az elektronfelhők kisebbek, mint a jelen esetben # 963; -csatlakozások. Ennek következtében a π-kötések általában kevésbé tartósak, mint a # 963; -csatornák, amelyeket ugyanazon atomgörbék alkotnak.
A p-orbitálok az # 963; -, és π-kommunikáció; többszörös kapcsolatokban az egyikük szükségszerűen # 963; -csatlakozás :.
Így egy három kötésű nitrogénmolekulában egy - # 963; -csatlakozás és két-π-kommunikáció.
A kötés hossza a kötött atomok magjainak távolsága. A különböző vegyületekben lévő kötések hossza tized egy nanométer. Amint a kötés hossza növekszik, az N-N kötési hossza csökken. N = N és NºN 0,145; 0,125 és 0,109 nm (10-9 m), és a C-C, C-C és C-C kötések hossza 0,154; 0,134 és 0,120 nm.
Különböző atomok között tiszta kovalens kötés jelenhet meg, ha az atomok elektronegativitása (EO) azonos. Az ilyen molekulák elektroszimmetrikusak, azaz Az atomok pozitív töltéseinek és negatív töltéseinek "súlypontjai" egy ponton egybeesnek, ezért nempolárisnak nevezik őket.
Ha az összekötő atomok eltérő EO-val rendelkeznek, akkor az egymás között elhelyezkedő elektronfelhő a szimmetrikus pozícióhoz képest egy nagyobb EO-val rendelkező atomhoz kapcsolódik:
Az elektronfelhő elmozdulását polarizációnak nevezik. Az egyoldalú polarizáció eredményeként a molekulában lévő pozitív és negatív töltések súlypontjai egy ponton nem esnek egybe, némely távolság (l) jelenik meg közöttük. Az ilyen molekulákat polárisnak vagy dipólusnak nevezik, és az atomok közötti kötést polárisnak nevezik.
A poláris kötés olyan kovalens kötés, amely jelentéktelen egyoldalú polarizáción ment keresztül. A molekulában lévő pozitív és negatív töltések "súlypontjainak" közötti távolságot dipolhossznak nevezzük. Természetesen minél nagyobb a polarizáció, annál hosszabb a dipólus hossza és annál nagyobb a molekulák polaritása. A molekulák polaritásának becsléséhez rendszerint egy állandó dipólus pillanatot (Mp) használnak, amely az elemi elektromos töltés (e) nagyságának a dipólus (l) hosszúságával való terméke. .
Dipólus momentum mért Debye D (D = 10-18 e. V. U. × cm, mert az elemi töltés 4,810-10 e. V. U. dipól hossza és az átlagos megegyezik a távolság a két mag atom, m . .e 10-8 cm), vagy coulometry (Cl × m) (D 1 = 3.33 # 903; Cl × 10-30 m) (elektron töltése 1,6 # 903; 10-19 coulomb szorozva közötti távolság a díjak például 0,1 nm, akkor Mp = 1,6 # 903; 10-19 × 1 × 10-10 = 1,6 # 903; 10-29 Cl # 903; m). A molekulák állandó dipólus pillanatai 0-tól 10-ig terjednek.
Nem poláros molekulák esetén l = 0 és Mp = 0, azaz. nincs dipol pillanatuk. A poláris molekulák esetében Mp> 0 és elérheti a 3,5-4,0 d értékeket.
A nagyon nagy különbség EO atomok kapcsolatban nyilvánvalóan egyoldalú polarizáció: elektron felhő kommunikáció maximálisan felé mozduljanak, az atom a legnagyobb EO atomok átjut ellentétes töltésű ionok és ionos molekula fordul elő:
A kovalens kötés ionos lesz. A molekulák elektrosimimetriája növekszik, a dipólus hossza növekszik, a dipólus pillanata 10 ° C-ra emelkedik.
Egy komplex molekula teljes dipólus pillanata egyenlő lehet az egyes kötések dipólus pillanatainak vektorösszegével. A dipólus pillanat általában a dipólus pozitív végétől a negatívig irányul.
A kapcsolás polaritásának előrejelzése relatív EO-atomok segítségével történhet. Minél nagyobb a különbség az atomok relatív EO-ban, annál erősebb a polaritás: DEO = 0 - nempoláris kovalens kötés; DOD = 0-2-poláris kovalens kötés; DEA = 2 - ionos kötés. Pontosabb a kötés ionicitásának mértékéről beszélni, mivel a kötések nem 100% -ban ionosak. Még a CsF vegyületben az ionos kötés csak 89%.
Az elektronok atomról atomra való átmenetének következtében létrejövő kémiai kötést ionosnak nevezzük, és a megfelelő vegyi vegyületek molekulái ionosak. A szilárd állapotú ionos vegyületek esetében ionos kristályrács jellemzõ. Az olvadt és oldott állapotban elektromos áramot vezetnek, magas olvadáspontú és forrási hőmérséklete van, és jelentős dipólus pillanat.
Ha figyelembe vesszük a kapcsolat elemeinek időtartama egy és ugyanazt a tételt, akkor a mozgás kezdetétől a végéig terjedő időszakra elsősorban ionos jellege helyébe kovalens. Például, a fluoridokat 2. időszakától LiF, BeF2, CF4, NF3, OF2, F2 iontartalma közleménye lítium-fluorid és fokozatosan gyengíti jellemzően helyébe kovalens kötéssel egy molekula fluoratom.
Így a kémiai kötés természete egységes: nincs lényeges különbség a kovalens poláris és ionos kötések megjelenésének mechanizmusában. Ezek a típusú kapcsolatok csak a molekula elektron-felhő polarizációjának mértéke szerint különböznek egymástól. A feltörekvő molekulák különböznek a dipólusok hosszában és az állandó dipólus pillanatok értékeiben. A kémia területén a dipólus pillanat értéke nagyon nagy. Általában minél nagyobb a dipólus pillanat, annál nagyobb a molekulák reaktivitása.
A vegyi kötés kialakulásának mechanizmusa
A vegyértékkötések módszerében megkülönböztetik a kémiai kötés kialakulásának csere- és donor-akceptormechanizmusát.
Csere mechanizmus. A kémiai kötés kialakítására szolgáló csere mechanizmus magában foglalja azokat az eseteket is, amikor egy elektron részt vesz az egyes atomok elektronpárjának kialakításában.
A 2., Li2, Na2 molekulákban a kötés az atomok páratlan s-elektronja miatt jön létre. Az F2 és Cl2 molekulákban - párosítatlan p-elektronok miatt. A HF és HCl molekulákban a kötéseket hidrogén-s-elektronok és halogén-p-elektronok alkotják.
A vegyületek képződésének sajátossága a csere mechanizmus révén a telítettség, ami azt mutatja, hogy az atom nem tartalmaz semmiféle, de korlátozott számú kötést. Számuk különösen a párosítatlan vegyértékektronsektől függ.
Az N és H kvantumsejtekből látható, hogy a nitrogénatom 3
párosítatlan elektronok, és a hidrogénatom egy. A telítettség elve szerint a stabil vegyület NH3, nem NH2, NH vagy NH4. Vannak olyan molekulák, amelyek páratlan számú elektront tartalmaznak, például NO, NO2, ClO2. Mindegyiket fokozott reaktivitás jellemzi.
A egyes szakaszait kémiai reakciók is képezhetjük vegyérték telítetlen csoportokat, amelyek úgynevezett gyökök, például H, NH2, O, CH3. A radikális reakcióképesség nagyon magas, ezért létük ideje általában csekély.
Adományozó-elfogadó mechanizmus
Ismert, hogy ammónia ammónia NH3 és BF3 bór-trifluorid vegyületei reagálnak egymással a reakcióban
NH3 + BF3 = NH3BF3 + 171,4 kJ / mol.
Tekintsük a reakció mechanizmusát:
Látható, hogy a négy bór pályája közül három lakik, és az egyik üres. Az ammóniamolekulában mind a négy nitrogénforgalom fel van töltve, amelyek közül három a nitrogén és a hidrogén elektronjainak cseréje, és az egyik elektronpárt tartalmaz, amelynek mindegyike elektronok, amelyek nitrogénhez tartoznak. Az ilyen elektronpárt egy nem osztott elektronpárnak nevezik. A H3N vegyület képződése # 903; A BF3 annak a ténynek köszönhető, hogy egy osztatlan elektronpár ammóniát foglal el a bór-fluorid üres orbitálisán. Ebben az esetben a rendszer potenciális energiája csökken és egyenértékű energiát szabadít fel. Hasonló kialakulási mechanizmust neveznek donor-akceptor donornak, amely atom elektronpárja kötést képez (ebben az esetben nitrogénatom); és egy atom, amely üres orbitalot biztosít, egy elektronpárt vesz, akceptornak (ebben az esetben egy bórban). A donor-elfogadó kötés egyfajta kovalens kötés.
A H3N vegyületben # 903; A BF3 nitrogén és a bór tetravalens. A nitrogénatom 3-ról 4-re növeli a valenciáját egy osztatlan elektronpár használatával, hogy további kémiai kötést hozzon létre. A bór atom növeli a valenciáját a szabad orbitális jelenléte miatt a valence elektron szintjén. Így, vegyértéke az elemek határozzák meg nemcsak száma párosítatlan elektronok, de a jelenléte a magányos elektronpár és szabad vegyértéke pályák az elektronikus szinten.
Egy egyszerűbb eset a kémiai kötés kialakulása által