Kémiai kötés fajtái
Kémiai kötés fajtái
Az összes elem külsõ héja, kivéve a nemesgázokat, ELVESZTETT és a kémiai kölcsönhatás folyamatában.
A kémiai kötés a külső elektronhéjak elektronainak köszönhetően keletkezik, de különböző módon valósul meg.
Három fő kémiai kötés létezik:
- kovalens kötés és fajtái: poláris és nem poláris kovalens kötés;
Az ionos kémiai kötés az anionok kationjainak elektrosztatikus attrakciója.
Ionos kötéssel történik szénatomok közötti, élesen egymástól eltérő elektronegativitása értékek, így egy elektronpár képez kötést erősen eltolva az egyik atom, így lehet tekinteni tartozó atom az elem.
Az elektronegativitás az a képesség, hogy a kémiai elemek atomjai maguktól vonzzák saját és más elektronjait.
Az ionos kötés természete, az ionos vegyületek szerkezete és tulajdonságai a kémiai kötések elektrosztatikus elméletének helyzetéből adódnak.
Például: 2Na 0 + Cl2 0 = 2Na + Cl -
Égés fémnátrium a klór oxidációs reakció eredményeként kapott -vosstanovitelnoy képződött nátrium-kationok erősen elektropozitív elem és anionok erősen elektronegatív klór- elem.
Következtetés: az ionos kémiai kötés keletkezik a fém és a nemfém atomok között, amelyek nagyon különbözőek az elektronegativitásban.
A kovalens kötés az atomok kötése közös elektronikus párokkal (osztva közöttük).
Tekintsük egy kovalens nempoláris kötés előfordulását egy hidrogén molekula két hidrogénatomból történő képződésének példáján. Ez a folyamat már egy tipikus kémiai reakció, egy anyag (atomhidrogén) miatt, egy másik molekuláris hidrogén keletkezik. Ennek a folyamatnak az energia "nyereségességé" külső jele a nagy mennyiségű hő elosztása.
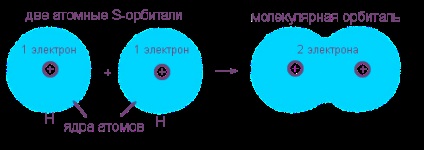
Elektronikus burkolatot a hidrogénatomok (egy s-elektron minden egyes atom) fuzionált teljes elektron felhő (molekulapálya), ahol mind az elektron „szolgáltatás” kernel-e „rá” egy mag vagy „idegen”. Az új elektronhéja hasonló a hélium inert gáza elektron elektronhéjjától: 1s 2.
A gyakorlatban egyszerűbb módszereket alkalmaznak. Például az amerikai chemist J. Lewis 1916-ban javasolta az elektronokat
a tétel szimbólumai mellett. Az egyik pont egy elektront képvisel. Ebben az esetben az atomokból származó hidrogén-molekula képződése a következőképpen íródott:
Vegyük figyelembe, hogy a klór elektronhéjainak szerkezetéből származó 17 Cl klór (a Z = 17 nukleusz töltése) kötődik a diatommolekulához.
A klór külső elektronikus szintjén s 2 + p 5 = 7 elektron található. Mivel az alsóbb szintek elektronjai nem vesznek részt a kémiai kölcsönhatásban, a pontok csak az elektronokat jelölik
harmadik szint. Ezek a külső elektronok (7 darab) három elektronpár és egy páratlan elektron formájában helyezhetők el.
Miután két párosítatlan elektront molekulába egyesítettünk, új elektronpárt kapunk:
Ebben az esetben minden klóratomot körülvesznek
elektronok. Ez könnyen ellenőrizhető a klóratomok bármelyik körforgatásával.
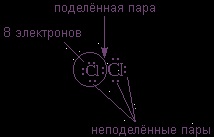
A kovalens kötést csak egy pár elektron képezi az atomok között. Úgy hívják
A fennmaradó elektronpárokat nevezik
Feltölti a héjat, és nem vesznek részt a kötésben.
Az atomok kémiai kötéseket alkotnak az ilyen számú elektronok szocializációjának eredményeképpen, hogy megszerezzék az elektronikus konfigurációt, amely hasonló a nemeselem atomok teljes elektronikus konfigurációjához.
Lewis elmélete és oktettje szerint az atomok közötti kötés nem feltétlenül egy, hanem egyben
Osztott párok, ha az okteti szabály előírja. Ilyen kapcsolatokat neveznek
dupla és háromágyas.
mindegyik atomhoz egy molekulát képezhet egy elektron oktettel, ha két osztott párt helyeznek el az atomok között:
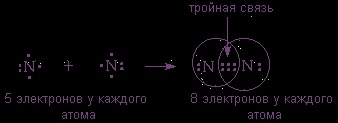
(2s 3 2p 2 az utolsó shell) is kötődnek kétatomos molekula, hanem a szervezet oktett elektronok szükséges helyezze el őket pár közötti három osztva:
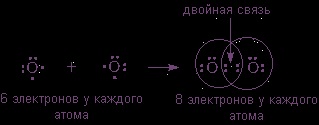
Következtetés: kovalens nempoláris kötés fordul elő az azonos elektronegativitású atomok között, vagyis egy kémiai elem - a nemmetál - atomjai között.
Például: a H2Cl2 molekulákban az N2P4 Br2 kovalens nempoláris kötés.
Poláris kovalens kötés
közbenső pozíciót foglal magában egy tisztán kovalens kötés és egy ionkötés között. Csakúgy, mint az ionos, csak két különböző atom között lehet.
Példaként tekintse meg a víz képződését a hidrogénatomok (Z = 1) és az oxigén (Z = 8) közötti reakcióban. Ehhez először meg kell jegyezni a hidrogén (1s 1) és oxigén (.2s 2 2p 4) külső héjainak elektronikus képletét.
Kiderül, hogy ehhez csak egy hidrogénatomra van szükség egyetlen oxigénatomonként. Azonban a természet olyan, hogy az oxigénatom akceptor tulajdonságai magasabbak, mint a hidrogénatomé (ennek okai egy kicsit későbbiek). Ezért a víz Lewis-formulájában lévő kötő elektronspárok kissé eltolódnak az oxigénatom magjához. A vízmolekula kötése poláris kovalens, részleges pozitív és negatív töltések jelennek meg az atomokon.
Következtetés: kovalens poláris kötés keletkezik a különböző elektronegativitású atomok között, vagyis a különböző kémiai elemek - nemmetálok atomjai között.
- kovalens poláris kötést.
Jelenleg szokásos elektronpárokat (vagyis kémiai kötéseket) ábrázolni az atomok között
Minden kötőjel egy osztott elektronpár. Ebben az esetben a már ismerős molekulák így néznek ki:
Az atomok közötti kötőjeleket strukturális képleteknek nevezik.
A strukturális képletek gyakrabban nem mutatnak magányos elektronpárokat
A szerkezeti képletek nagyon jól mutatják a képalkotó molekulákat: világosan megmutatják, hogy az atomok kapcsolatban vannak-e, milyen sorrendben, milyen kapcsolatokkal.
A Lewis-képletekben az elektronok kötőpárja megegyezik a strukturális képletekben szereplő egyik kötőjellel.
A kettős és hármas kötvényeknek közös nevük van -
Azt is mondják, hogy a nitrogénmolekula van
egyenlő három. Az oxigénmolekulában a kötésrend két. A kötés sorrendje a hidrogén és a klór molekuláiban egy. A hidrogén és a klór már nem sokszoros, hanem egyszerű kapcsolat.
A kommunikáció sorrendje a két kötõ atom közötti szocializált megosztott párok száma. A fenti három kommunikációs sorrend nem fordul elő.