A van der Waals erő - studopediya
A kölcsönhatás a molekulák között. komplex vegyületek
Az előző fejezetben vizsgálta interakció atomokkal molekulák és azt is mutatja, a struktúrák és tulajdonságai molekulák. Ez a fejezet a kölcsönhatás a molekulák.
Amikor közeledik a molekuláris vonzás miatt előfordul Vaeth előfordulásának kondenzált anyagok. A bázisok NYM típusú molekuláris kölcsönhatás kell tartalmaznia van der Waals erők, hidrogénkötések, donor-akceptor kölcsönhatás.
1873-ban a holland tudós J. van der Waals javasolta, hogy vannak olyan erők, amelyek hozzájárulnak a vonzás között Molek-Lamy. Ezek az erők később vált ismertté, mint a van der Waals-erők. Ezek közé tartozik a három összetevőből áll: egy dipól-dipól, indukciós és diszperziós kölcsönhatások.
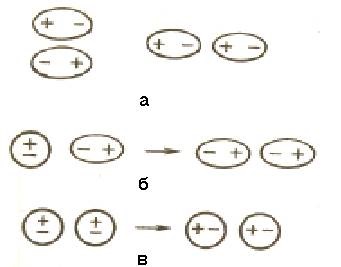
és - a dipól-dipól kölcsönhatás; b - indukciós kölcsönhatás,
a - reagáltatjuk a diszperziós
6.1 ábra - a van der Waals kölcsönhatás molekulák
6.1.1 dipól-dipól kölcsönhatás-hatásokat. Amikor konvergencia poláris molekulák azok ruyutsya-orientálható úgy, hogy a pozitív oldala a dipól orientálódott a negatív oldalon a másik dipól (6.1 ábra, a).
Között történik az E-dipólus kölcsönhatások úgynevezett dipol-dipol vagy tájolása. Az energia, a dipól-dipól kölcsönhatás arányos a villamos dipólusmomentuma negyedik hatványával, és fordítottan arányos a központjai közötti távolság a dipólusok a hatodik fokozat és sósav abszolút hőmérsékletű első fokú.
6.1.2 Indukciós kölcsönhatást. A dipólusok befolyásolhatja nem-poláris molekuláknak átalakítása indukált (Naveh-dennye) dipólusok (6.1 ábra, b). Között állandó és indukált mezők di vonzás lép fel, az energia, amely arányos az elektromos dipól pillanatban a második teljesítmény és fordítottan arányos a központjai közötti távolság a molekulák a hatodik fokozat. induktív kölcsönhatási energia növekedésével nő molekuláris polarizálhatóság rd, azaz a képességét, hogy a molekulát a dipól-máció hatása alatt egy elektromos mező. Polarizálhatóságot kifejezett érték térfogategységben. Polarizálhatóságot od notipnyh-molekulák együtt növekszik molekula méret (tablischa 6.1). Energia induktív kölcsönhatás jelentősen kevesebb energiát dipól-dipól kölcsönhatás.
6.1.3 diszperziós attrakció. A bármely molekula, amely elektromos sűrűségű ingadozások, így a pillanatnyi dipólusok jelenik meg, ami viszont indukálja az azonnali dipólusok szomszédos molekulák (6.1 ábra a). Mozgás pillanatnyi dipól válik koherens, a bomlási előfordulásuk és proish-dit szinkron. A kölcsönhatás dipólus pillanatnyi rendszer energiája csökken. Energia-diszperziós kölcsönhatás Következmény arányos a polarizálhatóságának a molekulák, és fordítottan arányos a távolság a középpontok között a részecskék. A nem-poláris molekuláknak diszpergált interakció az egyetlen összetevője a van der Waals-erők (6.1 táblázat).
6.1 táblázat - Hozzájárulás az egyes komponensek az energia a molekuláris kölcsönhatások
Cal villamos dipólusnyomatékkal D
Polyarizu- Emost m 3 * 30 okt
6.1.4 Az energia van der Waals kölcsönhatások. Van der Waals-energiát mindenféle interakció fordítottan arányos a távolság-niju központok közötti, a molekulák a hatodik fokozat.
Ha egy erős konvergencia erő taszítása molekulák jelennek-CIÓ közöttük, ami fordítottan arányos a távolság a molekulák a tizenkettedik mértékben. Ezért, a függőség a D-zultiruyuschey van der Waals kölcsönhatási energia EB a verseny-távolság molekulák között, az IB. alábbi egyenlet fejezi ki
ahol a és b - állandók.
A minimális energia a rendszer el van látva a távolságok középpontjai között a molekulák 0,4 ÷ 0,5 nm, azaz lényegesen nagyobb kötéshossz.
Amint az a 6.1 táblázat, a növekedés a molekuláris mérettartományban Ar és Xe-HC1-HI azok polarizálhatóságának növekszik, és az energia diszperziós-CIÓ vonzás. Orientációs kölcsönhatás nagymértékben hozzájárul felé, van der Waals-erők csak abban az esetben a molekulák, amelyek nagy elektromos dipólmomentum. A növekvő összegű-Marne energia az intermolekuláris kölcsönhatás növeli a forráspontja folyadékok és hője. A teljes energia a van der Waals kölcsönhatás molekulák 1-2 nagyságrenddel kisebb, mint az energia a kémiai kötések.
Így, ha a molekula viszonylag gyenge van der Waals kölcsönhatást, beleértve a diszperziós erők és poláris molekulákat és dipólus-dipólus vonzás és indukciós-nyos kölcsönhatást.