12 Alkálifémek
Alkálifémek. Oxidok, peroxidok, hidroxidok és alkálifémsók
12.1. Az alkálifémek általános jellemzői
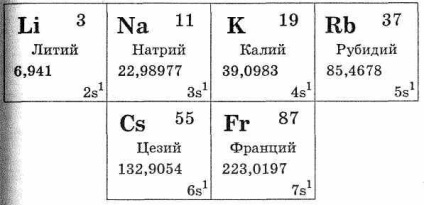
Az alkálifémek csoportja a következő elemsorozatokat tartalmazza: lítium-Li, nátrium-nátrium, kálium-K, rubídium Rb, cézium Cs, Fr. Fr. Ezek az időszakos rendszer I. csoportjának fő alcsoportjában vannak. Mindezek a fémek hasonlóak abban az értelemben, hogy külső elektronrétegen van egy elektron (lásd a 28. táblázatot). Az alkálifémek az s-elemek közé tartoznak. Az alkálifém atom külső elektronrétege elektronját az azonos periódus más elemeivel összehasonlítva eltávolítjuk a magból, azaz Az alkálifém atom sugara a legnagyobb az ugyanazon időszak elemeinek atom sugarához képest. Ebben az összefüggésben az alkálifém-atomok külső rétegének valence-elektronja könnyen leválasztható, pozitív töltésű ionokra cserélve. Ez annak köszönhető, hogy az alkálifémek más elemekkel alkotott vegyületei az ionkötés típusának megfelelően vannak kialakítva.
Az oxidációs redukciós reakciókban az alkálifémek olyanok, mint az erős redukálószerek, és ez a képesség a fémtől a fémig növeli az atommag töltésének növekedését.
Az I. csoport fő alcsoportjának elemeinek fizikai és kémiai tulajdonságai
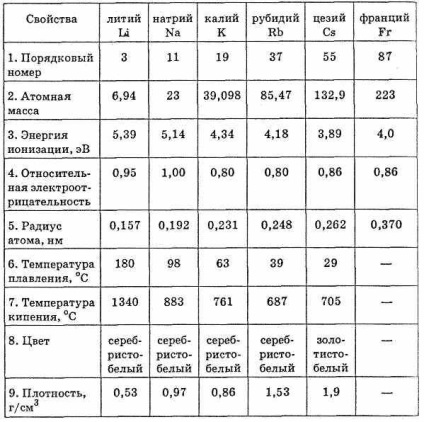
A fémek közül az alkálifémek a legmagasabb kémiai aktivitást mutatják. A feszültségek sorozatában az alkálifémek a sor elején helyezkednek el. A külső elektronszint elektronja az egyetlen valencia elektron, így az alkálifémek bármelyik vegyülete egyetlen valódi. Az alkálifémek oxidációs foka általában 1.
Az alkálifémeket könnyen levegőben, vízben és savakban oxidálják. Az oxidáció elkerülésére zárt (porszívózott) edényekben vagy éter, kerozin és hasonlók alatt tárolják őket. Az alkálifémek oxidációja oxigén atmoszférában nagyon erőteljesen zajlik, az R2O2 típusú fémperoxid képződésével. Oxidok csak speciális körülmények között kaphatók.
Az R2 O alkálifém-oxidok kifejezett bázikus tulajdonságokkal rendelkeznek, reagálnak a vízzel, savakkal és savas oxidokkal.
Amikor az alkálifémek vagy azok oxidjai vízzel reagálnak, alkálifém-hidroxidok - alkáli ROH keletkezik - erős bázisok, amelyek alapvető tulajdonságai növekszenek az elem atomszámával. Az alkálifémek redukáló tulajdonságai annyira hangsúlyosak, hogy ha hidrogénatmoszférában melegítik, hidrideket képeznek, amelyekben a hidrogén oxidációs foka -1. Az alkálifémek hidrogénvegyületei megfelelnek az RH képletnek. Fehér kristályos anyagok.
^ 12.2. Az alkálifémek előkészítése és kémiai tulajdonságai a nátrium és a kálium példáján
A természetben
Nátrium és kálium előállítása
A nátriumot klorid vagy nátrium-hidroxid elektrolízisével állítjuk elő. A NaCl olvadék elektrolízisének folyamán a katódon nátrium képződik:
Na e - Na ° a az anódban - klór: 2Cl - 2e - Cl 0 2
A NaOH-olvadék elektrolízisének során a katódon felszabadul a nátrium, és az anódon víz és oxigén szabadul fel:
A nátrium-hidroxid magas költségének köszönhetően a nátrium megszerzésének legfőbb modern módszere a NaCl olvadék elektrolízise.
A kálium az olvadt KC1 és KOH elektrolízisével is előállítható. Azonban ez a kálium-kinyerési módszer nem találta meg a technikai nehézségek (alacsony áramvisszaadás, nehézség a biztonsági berendezések biztosítása) miatt eloszlást. A kálium modern ipari termelése a következő reakciókon alapul: KCl Na = NaCl K (1)
Az (1) eljárás során a nátrium-gőzöt 800 ° C-on olvadt kálium-kloridon vezetjük át, és az így kapott káliumgőz kondenzálódik. A (2) eljárás során a megolvadt kálium-hidroxid és a folyékony nátrium közötti reakció 440 ° C-on nikkel reakcióoszlopban ellenáramban van.
A nátrium és a kálium ezüst-fehér fémek, nagyon puha, könnyen vágható késsel.
A természetes nátrium egy izotópból 23 11 Na, két stabil izotóp 39 19 K (93,26%) és 41 19 K (6,73%) és egy radioaktív 40 19 K (0,01%) káliumból áll. A tanulmányok mesterséges úton nyert radioaktív izotópokat használnak: 22 11 Na,
A nátrium és a kálium atomjai a kémiai kölcsönhatás során könnyedén kibocsátják a valence elektronokat, és pozitív töltésű ionokká alakulnak: Na és K. Mindkét fém erős redukálószer.
Ha a nátriumot és a káliumot kis mennyiségű oxigénben körülbelül 180 ° C-on oxidálják, akkor oxidokat kapunk:
A nátrium és a kálium könnyű és gyors oxidációjával összefüggésben kerozin vagy paraffin réteg alatt tárolják őket, mivel a paraffin tiszteletteljes, mivel A kerozinban bizonyos mennyiségű levegő feloldódik, és az oxidáció, bár lassú, előfordul.
A nátrium és a kálium hidrogénatomot - hidridet, ahol a hidrogén oxidációs állapota -1. Ez egy sószerű vegyület, amely különbözik az illékony víztől a kémiai kötés jellegétől és az oxidáció mértékétől.
A IV-VII. Csoport fő alcsoportjainak elemei. A fémhidrideket könnyen lebontják vízzel a megfelelő alkáli és hidrogénképződés céljából:
A nátrium és a kálium nemcsak oxigénnel és hidrogénnel reagál, hanem sok egyszerű és összetett anyaggal is: 2Na S = Na2S2K Cl2 = 2KSl
A nátrium és a kálium nemcsak egyszerű, hanem összetett anyagokkal is reagál, például vízzel, és ettől hidrogént kiszorítva:
A kálium még erősebben reagál a nátriumra: 2K 2N2 O = 2KOH H2 реаги
Lehetséges, hogy az alkálifémt vízzel el nem oltják. Ez ásványolajjal vagy talaj és NaCl keverékével van lefedve. A gázégő színtelen lángja sárga színű nátriummal és káliummal - ibolyával.
A nátriumot és annak ötvözeteit káliummal hőforrásként alkalmazzák atomreaktorokban. A nátriumgőz gázkisüléses lámpákkal van feltöltve. Nátrium - a fémkohászat (a Ti, Zr, Ta) előállításában a redukálószer katalizátorként szolgál szerves szintézisben és más területeken.
A káliumot elektrotechnikában használják, ez a fő | növények tápanyag-összetevője.
^ 12.3. Oxidok, peroxidok, hidroxidok és alkálifémsók sói a nátrium és a kálium példáján
A nátrium- és kálium-oxidok nem számítanak sokat. Erõteljesen reagálnak vízzel, így marószódát és kausztikus káliumot alkotnak:
Ezek az alapvető oxidok tulajdonságait mutatják.
A nátrium-peroxid Na2O2 sárgás por. Hidrogén-peroxid-sónak tekinthető, mivel szerkezete megegyezik a H2O2-val. Mint a hidrogén-peroxid, a peroxid-
A legerősebb oxidálószer a nátrium-hidroxid. Vízben oldva lúgot, hidrogén-peroxidot és oxigént képez:
A hidrogén-peroxid képződik hígított savak nátrium-peroxid hatásával is:
Nátrium-szén-dioxiddal a nátrium-peroxid a következő egyenlet szerint reagál:
Ezért légzőkészülékként használják fel levegőelnyelő szénmonoxid (IV) visszanyerését és oxigén szabadulását.
A nátrium-peroxidot ezenkívül a szövetek, csontok, haj stb.
Nagyon fontos vegyületek a nátrium-hidroxid vagy a nátrium-hidroxid-nátrium-hidroxid, úgynevezett marószóda vagy maró, valamint kálium-hidroxid vagy kausztikus kálium-hidroxid. Ők is nevezik maró lúgok. vízben könnyen oldódnak.
A kálium-hidroxid és a nátrium-hidroxid fehér, átlátszatlan, szilárd kristályos anyagok. Vízben nagy mennyiségű hőt termesztenek.
A vizes oldatokban szinte teljesen disszociálódnak, és erős lúgok:
NaOHhdeNa OH - KON kapcsolatosK OH -
Mutassa be a bázisok összes tulajdonságát.
A szilárd nátrium- és kálium-hidroxidok és vizes oldataik a szén-monoxidot (IV) abszorbeálják:
Szilárd állapotban a levegőben NaOH és KOH abszorbeálja a nedvességet, ezért gázok párátlanítójaként használják őket.
Az iparban nátrium-hidroxidot és kálium-hidroxidot állítanak elő NaCl és KC1 koncentrált oldatok elektrolízisével. Ugyanakkor egyszerre keletkezik a klór és a hidrogén. A katód egy háló, az anód grafit.
Számos szabványos elektródpotenciálban a kálium alumíniumig helyezkedik el, és ionjai sokkal nehezebbek kinyerni, mint a vízmolekulák. A H ionjai nagyon kis méretűek. Ezért csak a vízmolekulák kerülnek ki a katódon, a molekuláris hidrogén felszabadításával. A kloridionok koncentrált oldatban könnyebb elektronokat (oxidálják), mint a vízmolekulák, így a kloridionok kisülnek az anódon.
Az elektrolízis általános egyenlete ionos formában:
Hasonlóképpen a NaCl-oldat elektrolízise is folytatódik. A NaOH-ot és nátrium-kloridot tartalmazó oldat elpárologtatása következtében a nátrium-klorid kicsapódik (kevésbé oldódik, és kevéssé változik a hőmérsékleten), amelyet elkülönítenek és további elektrolízishez használják.
Az anód- és katódteret diafragmával választják el egymástól, így az így létrejövő termékek nem kölcsönhatásba lépnek egymással, például:
Cl2 NaOH = NaClO NaCl H20
A kaustikus szódát számos iparágban használják, például az olajfinomításhoz, zsírszappan gyártáshoz, papíriparhoz, mesterséges szálak és színezékek előállításához, gyógyszerek előállításához, a mindennapi élethez stb.
Egy drágább terméket, kálium-hidroxidot használnak kevésbé, mint a NaOH.
A nátrium és a kálium az összes savval sókat képez. A sók szinte minden oldata vízben oldódik. A legfontosabb ezek a következők.
A nátrium-klorid NaCl az élelmiszerekhez szükséges ízesítéssel, élelmiszertermékek megőrzésére szolgál, és nyersanyagként szolgál nátrium-hidroxid, klór, sósav, szóda stb. Előállításához.
A szóda alkalmazása - lásd a táblázatot. 25 o.
^ Nátrium-szulfátot Na2S04-et alkalmaznak a szóda és az üveg előállítása során. A vizes oldatokból egy tíz-
Na2S04 • 10H2O, Glauber sójának nevezik. Alkalmazva az orvostudományban hashajtóként.
Káliumsókat különös figyelmet kell fordítani, mivel néhányat széles körben használnak műtrágyákként:
1) nyers sók, amelyek őrölt természetes sók, elsősorban szilínium-klorid • kálium-klorid és ka-nit KCI • MgS04 • 3H20;
2) a természetes káliumsók feldolgozásának eredményeként nyert tömény műtrágyák KCl és K2S04;
3) kőzetgyapot K2 CO3-t tartalmazó fa és tőzeg hamu.