Kovalens kötés kialakulásának mechanizmusa
A különböző anyagok különböző szerkezetűek. Az eddig ismert összes anyag közül csak inert gázok léteznek szabad (izolált) atomok formájában, ami az elektronikus szerkezetek nagy stabilitásának köszönhető. Minden más anyag (és jelenleg több mint 10 millióan ismertek) kötődő atomokból áll.
Megjegyzés: dőlt betűkkel kiemelve azokat a szövegrészeket, amelyek nem taníthatók és nem szétszerelhetők.
Az atomokból származó molekulák képződése energiaenergiához vezet, mivel normál körülmények között a molekuláris állapot stabilabb, mint az atomállapot.
A külső energia szintjén lévő atom egy-nyolc elektront tartalmazhat. Ha az atom külső szintjén lévő elektronok száma a maximális, amelybe befogadható, akkor egy ilyen szintet befejezettnek neveznek. A befejezett szinteket nagy szilárdság jellemzi. Ezek a nemesgáz-atomok külső szintjei: a külső héliumnak két elektronja van (s2), a másiknak nyolc elektronja van (ns 2 np 6). Az egyéb elemek külső szintjei hiányosak és a kémiai kölcsönhatás folyamatában befejeződnek.
Valence-elektronok miatt kémiai kötés keletkezik, de különböző módon valósul meg. Három fő kémiai kötés létezik: kovalens, ionos és fémes.
A kovalens kötés kialakulásának mechanizmusa például egy hidrogénmolekula kialakulásában nyilvánul meg:
H + H = H2; Q = 436 kJ
A szabad hidrogénatom magját gömb alakú szimmetrikus elektronfelhő veszi körül, amelyet egy 1s elektron képez. Amikor az atomok egy bizonyos távolságra megközelítik egymást, az elektronfelhők részleges átfedése (orbitális)
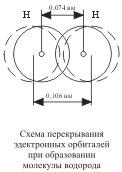
Ennek eredményeképpen mindkét mag középpontjai között molekuláris kételektron felhő jelenik meg, amely a magok közötti térben a legnagyobb elektronsűrűséggel rendelkezik; a negatív töltés sűrűségének növekedése elősegíti a magok és a molekuláris felhő vonzó erejének erős növekedését.
Tehát a kovalens kötés az atomok elektron-felhőinek átfedése eredményeként jön létre, melyet az energia felszabadítása kísér. Ha az érintéshez közelülő magok közötti távolság 0,106 nm, akkor az elektronfelhők (a H2 molekula képződése) átfedése után ez a távolság 0,074 nm. Az elektronfelhők legnagyobb átfedése két atom atomjait összekötő vonal mentén történik (ez akkor fordul elő, amikor # 963; -csatlakozás). A kémiai kötés annál erősebb, annál nagyobb az elektronikus pályák átfedése. A két hidrogénatom közötti kémiai kötés következtében mindegyik eléri a hélium nemes gáz atomjának elektronkonfigurációját.
A kémiai kötések megjelenítését különböző módokon alkalmazzák:
1) elektronok segítségével, az elem kémiai jelén elhelyezett pontok formájában. Ezután a hidrogénmolekula kialakulását a rendszer mutatja
H # 8729; + H # 8729; → H: H
2) gyakran, különösen a szerves kémiában, a kovalens kötést kötőjellel (például H-H) reprezentálják, ami egy közös elektronpárt ábrázol.
A klórmolekulában a kovalens kötés két közös elektron vagy egy elektronpár segítségével valósul meg:
Egy osztatlan elektronpár, a 3 atomjukban
← megosztatlan pár elektron,
↑ ↑ a molekulában 6.
párosítatlan elektron egy közös vagy osztott elektronpár
Amint láthatjuk, mindegyik klóratomban három osztatlan pár és egy párosítatlan elektron van. A kémiai kötés kialakulása az egyes atomok páratlan elektronjainak következménye. A párosított elektronok egy közös elektronpárhoz vannak kötve, amit megosztott párt is neveznek.
Ha az atomok között egy kovalens kötés van (egy közös elektronpár), akkor egyszemélyes; ha több, akkor több kettős (két közös elektronikus pár), egy háromszoros (három közös elektronikus pár).
Egyetlen linket egyetlen vonal (egy löket) képvisel, kettős két vonal, és hármas háromszög. A két atom közötti kötőjel azt mutatja, hogy egy elektronpár általánosított, ami kémiai kötést eredményezett. Az ilyen kötőjellel a molekulák szerkezeti képletét mutatjuk be.
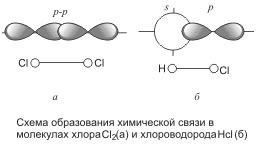
Tehát a klórmolekulában mindegyik atom rendelkezik nyolc elektron teljes külső szintjével (s 2 p 6), amelyek közül kettő (elektronpár) mindkét atomhoz tartozik. Az elektron-pályák átfedése a molekula kialakulása során az 1. ábrán látható.
Nitrogénmolekulában az N2 atomok három közös elektron párral rendelkeznek:
Nyilvánvaló, hogy a nitrogénmolekula erősebb, mint egy hidrogén- vagy klórmolekula, amely a kémiai reakciókban a nitrogén jelentős inertitásáért felelős.
Az elektronpárok által megvalósított kémiai kötést kovalensnek nevezzük.
Kovalens kötés kialakulásának mechanizmusa.
A kovalens kötés nemcsak egy elektron-felhők átlapolásával jön létre, hanem a kovalens kötés kialakulásának csere mechanizmusa.
Cserélő mechanizmus segítségével az atomok azonos számú közös elektront használnak.
A kialakulásának másik mechanizmusa is lehetséges: donor-akceptor. Ebben az esetben a kémiai kötés egy atom osztatlan elektron párjából és egy másik atom szabad orbitálisából származik.
Vegyünk példaként az ammóniumion NH4 + képződésének mechanizmusát
Az ammónia és a sósav kölcsönhatása során kémiai reakció következik be:
NH3 + HCl = NH4C1 vagy csökkentett ionos formában: NH3 + H + = NH4 +
Egy ammónia molekulában a nitrogénatom egy osztatlan elektronpárt (két elektronfelhőt) tartalmaz:
A hidrogénion szabad (nem töltődik be) az 1s-pályával, amelyet kijelölhetünk # 9633; H +
A formáció a ammóniumion orbitális átfedések nitrogénatom elfoglalta a nem megosztott elektronpárt egy üres orbitális a hidrogén-ion (két-elektron felhő válik közös nitrogénatommal nitrogén és hidrogén atomok, azaz átalakul molekuláris elektron felhő). Tehát van egy negyedik kovalens kötés. Az ammóniumion képződésének folyamata a következőképpen ábrázolható:
A hidrogénion-töltés közösvé válik (delokalizálódik, azaz minden atom között diszpergálódik), és a nitrogénhez tartozó két elektronfelhő (osztatlan elektronpár) közösvé válik a hidrogénnel. Az ábrákon a cellakép # 9633; gyakran elhagyják.
Egy olyan atom, amely egy osztatlan elektronpárt biztosít, adományozónak nevezik, és egy atom, amelyik veszi (azaz szabad orbitált biztosít), akceptornak nevezzük.
A két elektron elektronfelhőjének (donor) és a másik atom (orbitális) szabad orbitáljának kovalens kötésképződésének mechanizmusa donor-akceptornak nevezzük. Az ily módon képződött kovalens kötést donor-akceptor kötésnek nevezzük.
Ez azonban nem egy speciális kapcsolódás, hanem csak egy másik mechanizmus (módszer) egy kovalens kötés kialakítására. Tulajdonságok szerint a negyedik N-H kötés az ammóniumionban nem különbözik a másik három közül.