Fibrilláris fehérjék - kémiai hivatkozási könyv 21
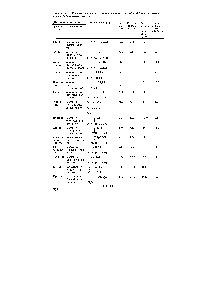
6.7. Táblázat. Az a-aminosavak fizikai-kémiai jellemzői, amelyek fibrilláris fehérjéket alkotnak
Fehérjék és enzimek. Globuláris és fibrilláris fehérjék. [C.264]
A fehérje és a polietilén vagy a polietilén-tereftalát (dacron) láncai közötti fő különbség az, hogy a fehérjemolekulában nem minden oldallánc azonos. A fibrilláris fehérjékben az oldalláncok bizonyos ismétlődő szekvenciája specifikus mechanikai tulajdonságokat kölcsönöz specifikus keratin proteinnek vagy kollagénnek. A globuláris fehérjék még összetettebbek. Ezek a molekulák általában 100-500 aminosavat tartalmaznak, amelyeket egy hosszú láncba polimerizálnak. és ugyanazon globuláris fehérjék mindegyik molekulájában az aminosavmaradékok teljes szekvenciája azonos. Ezek a csoportok lehetnek szénhidrogének, savasak, bázikusak, semlegesek vagy polárosak. A fehérje lánc konvolúciója egy kompakt gömbölyű molekulába [c.313]
A fehérjék az aminosavak polimerei. Fibrilláris fehérjék a haj, a bőr, a körmök, az izmok és az inak fő strukturális anyagai. Ezekben a struktúrákban a fehérjesáncokat szálas szálakkal ellátott szálakkal tekercseljük, vagy egymáshoz kapcsolódva hidrogénkötésekkel. A globuláris fehérjék közé tartoznak enzimek, hordozómolekulák és antitestek. Az ilyen típusú fehérjékben a láncok lehetnek spirálok vagy lemezek formájában. de ezek a struktúrák ismételten összehajtogatnak, kompakt, elkülönített molekulákká hajolva. [C.338]
Az 1950-es évek elején az amerikai kémikus, Linus Pauling (1901-ben született) azt javasolta, hogy a polipeptid lánc tekercselve legyen (spirális lépcsőként), és ebben a helyzetben hidrogénkötésekkel tartják. Ez az ötlet különösen gyümölcsözőnek bizonyult a viszonylag egyszerû fibrilláris fehérjék számára, amelyek fedõ- és kötõszöveteket alkotnak. [C.130]
A fehérje láncának alakja határozza meg a fehérje funkcióját a sejtben vagy szervezetben. Bizonyos fehérjéket egy golyóba (gömbölyű fehérjék) kell feltekerni. A többi szomszédos lánchoz tartozó oldalláncok interakciója sík vagy lineáris lineáris szerkezetek kialakulásával jellemezhető (fibrilláris fehérjék, 11.8 ábra [C.453]
Fibrilláris fehérjék (skl proteiNi) Polipeptidláncok. szálakat vagy spirálokat alkotnak, amelyek nagy része - az egyszerű aminosavak többnyire rosszul oldódnak a vízben [c.211]
A molekulasúlyok becslésére szolgáló módszereket adjuk meg. polidiszperzitás. a makromolekulák alakja és mérete, a polimerizáció és a polikondenzáció alacsony és mély konverziós arányokban történő szálképző polimerek szintézise. valamint alapvető információkat szolgáltat a cellulóz, a kitin és a fibrilláris fehérjék természetes szálképző polimerekének kémiai és fizikai-kémiai tulajdonságairól. A bemutató a kvantitatív példákon és a leggyakrabban felmerült problémákon alapul, amelyek a tudományos és technológiai munka gyakorlatában merülnek fel. [C.2]
Számítsuk ki a fibrilláris fehérje gömb alakú molekulájának diffúziós együtthatóját, amelynek molekulasúlya 10 és [72]
A fibroin és a szericin olyan fibrilláris fehérjék, amelyek a természetes selyem polimer bázisát alkotják. [C.375]
Néhány fibrilláris fehérje esetében [t] az oldat [120]
A második az, hogy a szálképződés olyan folyamat, amely a külső erőterek (mechanikai, elektromágneses, enzimatikus) alkalmazásának köszönhetően nem egyensúlyi orientált állapotba kerül. Ezért a fibrilláris fehérjék (fibroin kollagén) a leghatékonyabbak, mint a szálképző polimerek. [C.336]
Ez a Nal oldatban végrehajtott reakció használható fibrilláris fehérjék feloldására. [C.362]
Fibrilláris fehérjék, beleértve a hajat, a bőrt, az izmokat és a körmöket, strukturális funkciókat látnak el. Globuláris fehérjék. mint például enzimek és hormonok, egy specifikus biokémiai munkát végeznek. Hasonlítsuk össze a molekulák alakját és a két csoportba tartozó fehérjék vízben való oldhatóságát. Miért olyan gyakran különbözik a vízben való oldhatóság a fibrilláris fehérjékhez képest, mint a globuláris fehérjék vízben [457.]
Ezeket a reakciókat széles körben alkalmazzák a fibrilláris fehérjék technológiai kezelésében [c.362]
Az acilezés hatása a savkloridok fibrilláris fehérjéire mind az OH-, mind az NH2- [c.368]
A fehérjék egy másik nagy csoportja fibrilláris fehérjéket képez. A szervezetben elsősorban a szerkezeti anyagok szerepe szerepel. Közülük keratin. Ez része a bőrnek, a hajnak, a gyapjúnak, a körmöknek és más szőrös szöveteknek. A kollagén egy másik típusú fibrilláris fehérje. a rovarok szálai és szövetei, amelyek az inak, a bőr alatti rétegében és a szem szaruhártyáján a fibrillárisban találhatók. A fehérjék, a szénhidrátok és a lipidek (hosszú láncú és zsírsavas zsírok) az építőanyagok szerepét játszhatják minden élő szervezetben. [C.313]
Új ötletek szerint a fehérjék két morfológiailag különböző csoportra oszthatók: globuláris és fibrilláris fehérjék. Az első olyan kristályos, többé-kevésbé oldható vízben vagy sóoldatokban, olyan molekulákban, amelyek molekulái hasonlítanak egy uiap-hoz, egy ellipszoid rotációhoz. henger vagy lemez. Ilyen fehérjék például a hemoglobin és a mioglobin. A molekulák alakjára vonatkozó következtetéseket viszkoziméter, röntgen, osmometrikus mérések és elektronmikroszkópia alapján készítik. [C.396]
A fibrilláris fehérjék kölcsönhatása halogénezett savakkal gyengül az I> Br> Cl> F sorozat [c. 369]
A fibrilláris fehérjék módosításához epoxidációs reakciókat (például epiklórhidrint) használnak, valamint 7-es pH-jú bróm-etil-amint alkalmaznak. [C.370]
Fibrilláris fehérjék vannak jelen a haj, az izmok, a bőr és a lábak - [c.453]
A fibrilláris fehérje a-hélixét (3,6 aminosav-yx-maradék) a tengelyével párhuzamosan mérjük. Hossza 0,5 nm. Hány aminosav maradékot kell hozzáadni másodpercenként a keratinszál egyes a-hélixéhez, ha az emberi haj évente 15,24 cm-rel nő [c.119]
Ebben a helyzetben a fehérjék ezen csoportja nem oldódik fel a fibrilláris fehérjék feloldására használt oldószerekben. A fehérjék elsődleges struktúrájának egyik jellemzője. amely a keratin csoporthoz tartozik. viszonylag nagy mennyiségű kéntartalmú egység (Met, ys, yS - Sy). [C.377]
Molekulák formájában az összes fehérje két nagy csoportba tartozik (vagy fibrilláris) és globuláris. Az első vízben oldhatatlan hosszú filamentum molekulák. amelynek polipeptidláncai nem globuláris alakúak. és egy tengely mentén meghosszabbítva. A legtöbb fibrilláris fehérje szerkezeti vagy védelmi funkciókat valósít meg. [C.425]
A fibrilláris fehérjéket a poláris csoportok rendszeres elrendezése jellemzi egy hosszú merev polimerlánc mentén. Az egyik legjellemzőbb fibrilláris fehérje-kollagén esetében az irodalmi adatok az ultrahang sebességét az oldatban [202] adják, részleges adiabatikus összenyomhatóságot számoltam [161]. amelynek értéke abnormálisan alacsony. A kompresszálhatósági skála (lásd a 3.12. Ábrát) a teljes kinyúló kollagénlánc adalékszámításának bemutatása. Ez az érték olvasható [c.60]
A polimer anyagok előállításához szükséges nyersanyagokkal kapcsolatos helyzet is változik. Az elmúlt 40-50 év, a fejlesztés a termelés és feldolgozás szálképző polimer anyagok használatán alapuló természetes termékek mély feldolgozás szénhidrogén nyersanyag. Mivel azonban a gyors progresszív kimerültség a világ olaj- és földgázkészletek egyre nagyobb figyelmet fordítanak a problémát a műszaki újrafelhasználása a természetes polimerek - különböző polycarbo- és rostos fehérje, amely hozzájárul a sikeréhez a géntechnológia és egyéb területeken a biotechnológia. [C.8]
A természetes szálképző polimerek fizikai és kémiai tulajdonságainak komplexit a szerkezeti szervezet elsődleges, másodlagos és magasabb szintjei kondicionálják. A szálképző (cellulóz, kitinus fibrilláris fehérjék) mindegyikének polimerjei bizonyos biofunkcionális célokat szolgálnak. A bioszintetikus folyamatok sajátossága, hogy ezeknek a polimereknek a makromolekulák elsődleges szerkezete szabályos formában alakul ki, annak ellenére, hogy véletlenül bekerülnek a "hibás" kapcsolatokba. A polimer láncok szerkezetének szabályossága előre meghatározza az önrendelkezésük (kristályosodás) lehetőségét. A természetes szálképző polimerek makromolekulák rugalmassági paramétere némileg magasabb, mint 0,63, ami lehetővé teszi számukra, hogy félig merev láncú polimereknek minősüljenek. [C.288]
A kérdés. A természetes selymet elsősorban a Bombyx mon selyemhernyók békaféreg fizikai-kémiai kezelésével állítják elő. A rovarok hernyója által alkotott gubók természetes összetett héj, erős fibroin rostokból (rudakból) épülnek fel, amelyeket egy másik lineáris fehérje - szericin kapcsol össze (6.8. Táblázat). A kórokozó baktériumok elleni védelem érdekében a gáz és a víz cseréje a környezettel, a szálak felületét, amelyből a gubó épül. amelyet egy vékony féligáteresztő fehérje-lipid bevonattal borítanak. A cocoon filamentum 97-98% -ban erősen orientált fibrilláris fehérjékből áll [c.342]
Hatalmas számú kölcsönhatás az a-aminosav egységekben a polipeptidláncban. ami a fehérje primer struktúráját okozza. előre meghatározza a fehérjék nagyon sokféle változatának és funkcióik sajátosságának a lehetőségét. Azonban a fehérje elsődleges szerkezete. amelyek specifikus funkcionális tulajdonságokkal rendelkeznek (például fibrilláris fehérjék), a bioszintézis folyamatában meglehetősen pontosan reprodukálják, ami a szervezetek létfontosságú aktivitásának lehetőségét okozza. Korábban már említettük, hogy a polipeptid láncon belüli konformációs átmenetek főként a Gly-csoport körüli rotáció eredményeképpen valósulhatnak meg, amely csukló szerepet játszik. [C.344]
A kölcsönös rendelési a polipeptid láncok (kristályosító) fordul elő a nem csak a legalább csökkentse a víztartalom a rendszerben (ha szárított fehérje szubsztrát), hanem melegítéssel inert atmoszférában. A kristályosodási folyamatok maximális sebessége a természetes selyem-fibroin és a sericin fehérje összetevőinél 180-200 ° C tartományban van. Amorf sericin könnyen oldódik vízben 20 ° C-on pH 7,0 (0,1), míg a kristályos forma gyakorlatilag oldhatatlan. A fibroin és a szericin üveg átmeneti hőmérséklete Gc közel 173-175 ° C és 169-172 ° C tartományba esik. Mindkét rostos protein alkotó 97-98 tömeg% gubó menet, haraeterizuyutsya megközelítőleg egyenlő az affinitása a hidratációs víz hő fibroin és sericin rendre 50,9 és 52,1 kJ / mól. [C.376]
Az a-glargal szerkezete a globuláris fehérjemolekulák (pl. Enzimek) legfontosabb és legelterjedtebb rendszere. A p-hajtogatott réteg szerkezetét fibrilláris fehérjék, például fibroin-selyem és p-keratin (bőr, haj, körmök, kürtös patkányok stb.) Tartalmazzák. [C.271]
A fibroin selyem és a k-formájú p-forma a fibrilláris fehérjék csoportjába tartozik, amelyekben szinte teljesen kibontakoztatják a polipeptidláncokat hajtott struktúrába. [C.271]
Fibrilláris vagy szálas fehérjék (a latin a Gov gSha - rost) állnak makromolekulák formájában vékony hosszúkás szálak, általában összekapcsolt. Ez a csoport magában foglalja a fehérjék, amelyek összetevői a bőr és inak (kollagén. Zselatin), a haj és a kürt (keratin), izomba (miozin), és mások. A szervezetben működnek alapvetően mechanikus művelet, bár néhány fibrilláris proteinek biológiai aktivitással rendelkeznek . Tehát a fent említett myosip egy olyan enzim, amely az adenozin-trifoszfátot (ATP) hasítja, amely sok energiával rendelkezik. felszabadult felosztása során. [C.338]
A fibrilláris fehérjék szobahőmérsékleten általában oldhatatlanok a vízben, de képesek duzzadni benne. ami jelzi a hidrofil tulajdonságait. [C.338]
Fibrilláris proteinek álló polipeptid lánc összekapcsolt elsősorban vohyurodnoy komplex kötést képez helikális struktúrák nevezett fehérjék másodlagos szerkezete (ábra. 39). [C.360]