Elektronikus hatások szerves molekulák, tartalom platform
Elektronikus hatások szerves molekulák.
Elektronikus hatások - elmozdulása az elektronsűrűség a molekulában,
ion vagy gyök, hatása alatt szubsztituensek.
Szubsztituens bármelyik atomján (hidrogénatomtól eltérő), vagy egy olyan csoport atomok.
kapcsolódik egy szénatomhoz.
Megkülönböztetése induktív és mezomer elektron hatásait szubsztituensek.
A indukciós hatása (I-Effekt) - eltolódását elektronsűrűség a láncban
s -kötéseken különbségek miatt a elektronegatív atom.
Mivel a gyenge polarizálhatóságot s -kötéseken I - hatás bomlik gyorsan távolság
Helyettes Kommunikációs és 3-4 lesz szinte egyenlő 0.
Induktív hatást nevezzük negatív (- I), ahol a szubsztituens csökkenti
az elektronsűrűség a szénatom, amely kapcsolódik szubsztituens.
Ha a szubsztituens szerez részlegesen negatív töltéssel (D-), és az atom
szén - parciális pozitív töltéssel rendelkezik (d +). eltolási irányára
az elektron sűrűsége az összes S -kötéseken jelzett egyenes nyilak
(Over link) és részleges szimbólumok díjak indukált szubsztituens.
H3C d + ® Cl d - (- I - hatása a klóratom)
-I-hatás mutatnak tartalmazó helyettesítők elektronegatívabb
Induktív hatást nevezzük pozitív (+ I). ha a helyettes
növeli az elektronsűrűség a szénatomon indukáló erről
részlegesen negatív töltéssel (D-), így ő megszerzése a töltés d +.
Példa: H3C d - Li d + (+ I - hatása lítiumatom)
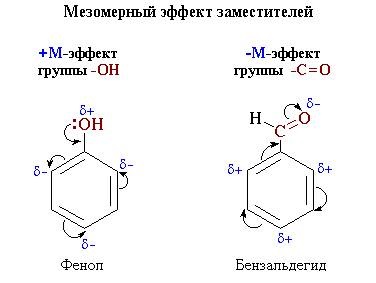
Mezomer hatása (M -effect) - eltolódását elektronsűrűség a láncban
delokalizált (konjugált) p -kötéseken (lásd. 4.10). ez a hatás
mutatják szubsztituensek kapcsolódó sp 2 - vagy SP - hibridizált atom.
Mivel a mobilitása elektronok p, M -effect által továbbított konjugációval áramkör
+M-hatás szubsztituenseket, amelyek növelik az elektronikus sűrűség
konjugált rendszer. Ezek közé tartoznak a csoportok, amelyek tartalmaznak atomok
magányos elektronpár átadására képes elektronok ebben a pár
közös interfész rendszer. M + -effect jellemző -OH és -NH2 csoportok
-M-hatás az elektronegatív szubsztituenseket hordozó mutatnak atomok és
előfeszítő az elektronsűrűség magát. - M-hatás jellemző a csoportok
-CH = O. COOH. -NO2. Bár ezek a csoportok egy magányos elektronpár,
térbeli elrendezése pályák ezen elektronok nem teszi lehetővé
őket, hogy kezdjenek párosítás rendszer. Így, ebben az esetben a szubsztituens
csak késlelteti az elektronok a közös interfész rendszer miatt
magasabb elektronegativitási.
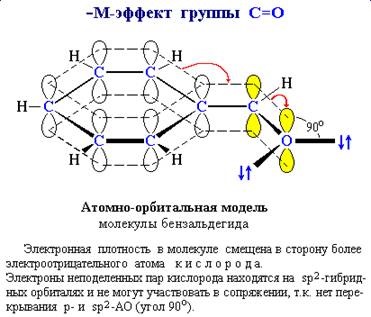
Annak megállapításához, a jele M-hatás hasznos építeni atomi modellt.
tükrözve a térbeli tájékozódás a pályák és azok lehetséges
átfedés (lásd. 4.9 pont). Így, ha a p orbitális a többszörös kötést C = O, és
SP 2 - pályák lone elektron pár a oxigénatom
Ezek merőlegesek egymásra, és nem tudnak átfedés
Nem E-oxigén gőz nem lehet továbbítani, hogy a p-rendszer.
Következésképpen, a szubsztituens tartalmazó C = O-csoport nem mutat M +.
és - M-hatás (ris_6_4_1.
az elektronsűrűség az elmozdulás irányában hatása alatt a M-hatás
jelöljük ívelt nyilak (ris_6_4_2).