Elektronikus hatások a fajok molekuláiban és az átviteli mechanizmusban
Elektronikus hatások - az elektronsűrűség elmozdulása egy molekulában, ionban vagy radikollal a szubsztituensek hatására.
Bármely atomot (a hidrogén kivételével) vagy egy szénatomhoz kötött atomcsoportot szubsztituensnek tekintünk.
A szubsztituensek induktív és mezomerikus elektronikus hatásai vannak.


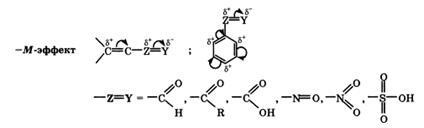
+Az M-hatás a -OH és -NH2 csoportokra jellemző. Az M-effektust az elektronegatív atomokkal rendelkező szubsztituensek mutatják ki és az elektron sűrűséget önmagában kiszorítják. A -M-hatás a -CH = O, -COOH, -NO2 csoportokra jellemző. Bár ezek a csoportok nem osztott elektron párokkal rendelkeznek, ezeknek az elektronoknak a térbeli elrendezése nem teszi lehetővé a kapcsolódási rendszerbe való belépést. Így ebben az esetben a szubsztituens csak a legmagasabb elektronegativitás miatt húzza ki az elektronokat a közös kapcsolórendszerből.
A szerves vegyületek savtartalma és bázikussága.
A szerves vegyületek savasságának és bázikusságának megítéléséhez a két legfontosabb elmélet Bronsted elmélete és Lewis elmélete.
Lewis-elmélet szerint a vegyületek savas és bázikus tulajdonságait az a képességük határozza meg, hogy képesek-e fogadni vagy kibocsátani egy pár elektront egy kötés kialakításával. Az LMCO elvének megfelelően a savak és a Lewis bázisok kemény és lágy részekre oszthatók.
A Lewis-savak olyan atomok, molekulák vagy kationok lehetnek, amelyek üres orbitalot tartalmaznak, és képesek arra, hogy egy pár elektront kapjanak kovalens kötés kialakításával.
A Lewis-savak egy pár elektron elfogadói; A Lewis-bázisok elektronpár-donorok. A Lewis-bázisok (atomok, molekulák vagy anionok) legalább egy pár valence-elektront kell tartalmazniuk, amelyet a partner számára kovalens kötést képezhetnek. Valamennyi Lewis bázis nukleofil reagens.
A Bronsted (protolitikus elmélet) elmélete szerint a vegyületek savasságának és bázikusságának összefüggésbe hozható a H + proton átvitelével. A sav és a bázis egy konjugált sav-bázis párt alkot, amelyben az erősebb a sav, annál gyengébb a bázis, és fordítva, annál erősebb az alap, annál gyengébb a hozzá kapcsolódó konjugált sav.
A rozsdásodott savak (protonsavak) semleges molekulák vagy ionok, amelyek képesek proton (proton donorok) visszaadására.
A Bronsted bázisok semleges molekulák vagy ionok, amelyek képesek protont (proton akceptorokat) csatolni.
A savasság és a bázicitás nem abszolút, de a vegyületek viszonylagos tulajdonságai: a sav tulajdonságait csak egy bázis jelenlétében lehet kimutatni; alapvető tulajdonságok - csak sav jelenlétében. A vizet rendszerint oldószerként használják a savas-bázis egyensúly vizsgálatakor.
Jellegétől függően az elem van társítva pro-tone megkülönböztetni OH savat (karbonsavak, fenolok, alkoholok), SH-sav (tiolok), NH-sav (aminok, amidok, imidek), CH-sav (szénhidrogének és származékaik). Az elemet és az ahhoz kapcsolódó hidrogénatomot savas közegnek nevezik. Minden esetben az elektronsűrűség eltolódása a hidrogénatomtól a több elektronegatív atomig terjed, a proton többé-kevésbé könnyen elszakad. Minél magasabb a proton kötőelemének elektronegativitása, annál nagyobb a vegyület savassága (például a karbonsavak erősebb savak, mint a tiolok vagy aminok).
Az elektronvesztegető csoportok molekulájában jelenlévő, negatív elektronikus hatásokkal rendelkező molekulák megnövelik a proton pozitív töltését, ami növeli a savas tulajdonságokat.
A protonnal való kovalens kötés kialakításához a Bronsted bázisoknak vagy elválasztott elektronpárt vagy p-kötésű elektront kell biztosítaniuk. Ennek megfelelően a Bronsted bázisok n-bázisokra és p-bázisokra vannak osztva.
Az n-bázisok semlegesek vagy negatívan töltöttek. Általában az anionok sokkal hangsúlyosabbak, mint a semleges anyagok. Azaz, az amidion-NH2- vagy hidroxid-ion HO - alapvetően meghaladja az NH3 ammóniát és a víz H2O-t.
P-bázisokban, amelyek magukban foglalják az alkéneket, alkadieneket, aréneket, az bázikusság központját, azaz a proton kötőhelye, a p-kötés elektronja. Ezek nagyon gyenge bázisok, mivel a protonált elektronpárok nem szabadok.
Az elektron-donor szubsztituensek jelenléte növeli a szerves vegyületek bázikusságát.
1. Savasság függ a heteroatomtól.
A heteroatom természetét úgy értjük, mint az elektronegativitást (EO) és a polarizálhatóságot. Minél több (EO), annál könnyebb a heterolitikus törés a molekulában. A balról jobbra tartó időszakokban, a mag növekedésének növekedésével nő (EO), azaz a az elemek képesek negatív töltést tartani. Az elektronsűrűség elmozdulása következtében az atomok közötti kötés polarizálódik. Minél több elektron és annál nagyobb az atom sugara, annál nagyobb a külső energia szintjének elektronjai a magból, annál nagyobb a polarizabilitás és annál nagyobb a savasság.
Példa: CH-NH-OH-SH-
növekedés E.O. és a savasság
A C, N és O elemek ugyanabban az időszakban vannak. EO az időszak nő, a savasság növekszik. Ebben az esetben a polarizálhatóság nem befolyásolja a savasságot.
Az atomok polarizálhatósága az időszakban jelentéktelenül változik, ezért a savasság meghatározó fő tényezője az E.O.
Most fontolja meg az SH-
O, S - csoportok ugyanabban a csoportban vannak, a csoport sugara emelkedik felülről lefelé, ezért az atom polarizálhatósága is nő, ami a savasság növeléséhez vezet. S-ben az atom sugara nagyobb, mint az O, ezért a tiolok erősebb sav tulajdonságokkal rendelkeznek, mint az alkoholok.
2. A szénhidrogéncsoport és az ott jelen lévő szubsztituensek hatása
Az elektronkivonó (EA) szubsztituensek hozzájárulnak az elektron sűrűségének delokalizációjához, ami anionstabilitáshoz és ennek megfelelően a savasság növeléséhez vezet.
Az elektrondonorozó (ED) szubsztituensek ezzel ellentétben hozzájárulnak az elektronsűrűség koncentrációjához a savas közegben, ami a savasság csökkenéséhez és az alapvetőség növekedéséhez vezet.
Az oldott anyag molekuláinak vagy ionjainak egy oldószerrel történő kölcsönhatását szolvatációs eljárásnak nevezzük. Az anion stabilitása jelentősen függ az oldatban való szolvatációjától: annál szolvátosabb az ion, annál stabilabb, és annál nagyobb a szolvatáció, annál kisebb az ionméret és kisebb a negatív töltés delokalizációja.