Meghatározása az adiabatikus index
Célkitűzés: Annak vizsgálata adiabatikus index a levegő.
Annak meghatározására, az adiabatikus index használt telepítési Nicolas Clément, amelynek a diagramját a ábrán látható. 1.1.
Ábra. 1.1 Telepítés Nicolas Clément
Ahhoz, hogy a henger 1 kapacitása 10-15 liter, amely a teszt gázt, a csap 4 csatlakozik a 2 szivattyú lehetővé teszi, hogy növelje a nyomást, mint a légköri. A felesleges nyomást mérjük egy U-alakú manométer 3 a szintkülönbség H a folyadék a térd. Crane 5 szolgál szakaszos felszabadulását gáz.
Ha a ballont felfújjuk gáz (például levegő) egy P1 nyomás. nagyobb, mint P0. Ez jellemzi a gáz halmazállapotban paramétereket P1. V1. T1 megfelel az 1. pont és a PV diagram (ábra. 1) (Vigyázat A továbbiakban V betű jelöli a fajlagos térfogat, vagyis a által elfoglalt térfogat egy egységnyi tömegű gáz. Ez kényelmes számítás, mivel a feltételeket a gáztömeg tapasztalatok az edényben változik.)
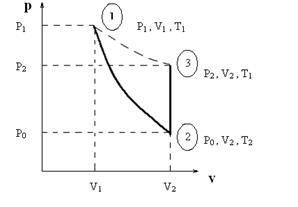
Ábra. 1.2. P-V diagramját a gáz folyamatok.
Ha egy rövid ideig, hogy nyissa ki a palackot szeleppel, majd a gázt fog megjelenni, és a nyomás a henger belsejében csökken a légköri P0. Ebben a gáz kitágulása miatt a rövid időtartama annak áramlását, úgy lehet tekinteni, adiabatikus. azaz nélkül hőcserélő fellépő a környezetével; Ez a folyamat is nevezik izentropikus. mert ha nincs változás entrópia. Az új állam a gáz lesz jellemző paraméterekkel P0. V2. T2 (2. pont ábrán. 1.). Mivel szerint az első főtétele, munka gáz adiabatikus folyamat miatt előfordul, hogy a csökkenés a belső energia, a gáz hőmérséklete ezáltal csökkentjük, azaz a T2 <Т1. Переход из состояния «1» в состояние «2» описывается уравнением Пуассона для адиабатического процесса, следовательно:
ahol g - aránya specifikus melegíti, és a definíció szerint ez egyenlő:
ahol Cp - fajhője gáz állandó nyomáson
Cv - gáz hő állandó térfogaton.
(Emlékezzünk, hogy a moláris hőkapacitás a hőmennyiséget, amely szükséges a hő az anyag 1 mol 1 K)
ahol R = 8,31 J / (mol K) - egyetemes gázállandó; arány Cp / Cv = (i + 2) / i, (1.4)
ahol i - a száma szabadsági fok a molekulák A vizsgálati gáz: az egyatomos gáz i = 3, hogy i = 5, kétértékű, többértékű i = 6.
Egy idő után bezárása után a csap visszamaradó gáz a hengerben melegítjük állandó térfogaton, hogy a környezeti hőmérséklet T1. Sőt, a nyomás értékre növeljük P2 (3. pont ábrán. 1.). A módszer Nicolas Clément nyomás mérés alkalmazásával előállított U-alakú szelvény (lásd 2. ábra ..); h csepp folyékony szintmérő lehetővé teszi meghajlik, hogy meghatározzuk a gáz nyomása a hengerben P1 és P2, illetőleg:
Az utolsó (3. pont) és a primer (1 pont) állapotának megfelelően a gáz, hogy ugyanezen a hőmérsékleten T1 és a kapcsolódó Boyle egyenlet izotermikus folyamat:
Ahhoz, hogy egy általános képletű kapcsolatos a izentropikus kitevő a mért paraméterek, felálló egyenlet (1,5) a hálózati g és elosztjuk termwise a (1.1) egyenlet:
Logaritmusát véve egyenlet (1.7), azt találjuk:
Express a különbség a gáz nyomás révén a folyadékszint a manométer, kiindulási anyagként (1,5) egyenletbe (1.8). megkapjuk
vagy transzformáció után:
h1 / P0 és kapcsolat (h1 -H2) / P0 lényegesen kisebb, mint az egység, azonban segítségével egy közelítő képlettel ln (1-x) @ x a kis értékei esetén x. kapott (1.10)
Ez a képlet számítjuk, hogy meghatározzuk az adiabatikus index g.