Visszafordíthatatlanságáról termikus eljárások - a termodinamika második törvénye
hőenergia termodinamika entrópia
A termodinamika első főtétele nem hoz létre az irányt termikus eljárások. A tapasztalat azonban azt mutatja, hogy sok termikus folyamatok történhetnek csak egy irányban. Az ilyen folyamatokat nevezik visszafordíthatatlan. Például, termikus kapcsolatban két test között, eltérő hőmérsékletű a hőáramlás mindig irányul a melegebb test egy hűvösebb. Ez soha megfigyelt spontán folyamat hőátadás a test egy alacsony hőmérsékletű, hogy egy testet magasabb hőmérsékleten. Következésképpen, a hőcserélő folyamat a végső hőmérséklet-különbség visszafordíthatatlan.
Eljárások úgynevezett reverzibilis átmenetek a rendszer egyik egyensúlyi állapotból a másikba, ami lehet elvégezni keresztül fordított irányban azonos szekvenciája közbenső egyensúlyi állapotok. Ebben az esetben a rendszer maga és a környező szervezet vissza az eredeti állapotába. Az a folyamat, amely a rendszer mindig marad egy egyensúlyi állapotban, az úgynevezett kvázi-statikus.
Minden kvázi-statikus folyamatok reverzibilisek. Minden reverzibilis folyamatok kvázi-statikus. Ha a munkaközeg a hőerőgép érintkezésbe hozzuk egy hőtároló, a hőmérséklet a hőcserélő folyamat változatlan marad, ez csak reverzibilis izoterm kvázisztatikus folyamat előforduló infinitezimális hőmérséklet-különbség és a munkaközeg tartályt. Ha van két hő tározók különböző hőmérsékleteken végezhetjük reverzibilis folyamatok két szigetelő részletben. Mivel adiabatikus folyamat is elvégezhető mindkét irányban (az adiabatikus kompresszió és az adiabatikus expanzió), a ciklikus folyamat, amely két izotermák és két adiabatikus (Carnot-ciklus) az egyetlen reverzibilis ciklikus folyamat, amelyben a munkafolyadék termikus kapcsolatban csak két hő tározók.
Minden más körkörös elvégzett folyamatok két hő tározók, visszafordíthatatlan. Irreverzibilis olyan folyamatok a konvertáló mechanikai munka be belső energiája a test, mert a súrlódás, a diffúziós folyamatok gázok és folyadékok, a keverési folyamat gáz jelenlétében a kezdeti nyomás különbség, és így tovább. D. Minden valós folyamatok visszafordíthatatlan, de önkényesen szorosan megközelíti reverzibilis folyamatokat. Váltvaforgató folyamatok eszményítésével a tényleges folyamatok. A termodinamika első főtétele nem tud különbséget tenni visszafordítható visszafordíthatatlan folyamatokat. Egyszerűen megköveteli, hogy bizonyos termodinamikai folyamat nem beszélnek az energiamérleg és a kijelentés, hogy egy ilyen folyamat lehetséges-e vagy sem.
Az irány spontán lejátszódó folyamatok létrehozza a termodinamika második törvénye. Készítmény lehet formájában egy tilalmat bizonyos típusú termodinamikai folyamatokat. Angol fizikus, William Kelvin adta 1851-ben a szövege a második törvény. A periodikusan működő hőerőgép folyamat nem lehetséges, az egyetlen eredmény, amely átalakítható mechanikai munkáját az egész hőmennyiség nyert egyetlen termikus tartályt. Feltételezett hőerőgép, ami egy folyamat, amely az úgynevezett „örökmozgó a második fajta.” A földi körülmények között, ez a gép ki tudja választani a hőenergia, például az óceánok és kapcsolja be egy teljesen működőképes.
A víz tömege az óceánok körülbelül 1021 kg, és ahogy lehűl egy mértékben, hogy kiemelje a hatalmas mennyiségű energiát (# 63 1,024 J) egyenértékű 1017 kg a teljes égés a szén. Évente keletkező energia a Földön körülbelül 104-szor kisebb. Ezért „egy örökmozgó, a második fajta” az lenne, hogy az emberiség nem kevésbé vonzó, mint a „örökmozgó az első fajta”, betiltották az első főtétele. Német fizikus R. Clausius adott másik megfogalmazása a termodinamika második törvénye: nem lehet feldolgozni egyetlen eredménye az lett volna, az energia átvitelét a hőátadás a test alacsony hőmérsékleten a test magasabb hőmérsékleten. Ábra. Az 1. ábrán eljárások tiltott második törvény, de nem tilos az első főtétele. Ezek a folyamatok megfelelnek a két készítmény a termodinamika második törvénye.

Az 1. ábra a folyamatokat, amelyek nem mondanak ellent a termodinamika első főtétele, hanem tiltja a második törvény:
1 - „egy örökmozgó A második típusú”; 2 - spontán hőátadást hideg test egy meleg ( „ideális hűtőgép”).
Meg kell jegyezni, hogy mind a szövege a termodinamika második törvénye egyenértékűek. Ha feltételezzük, hogy például hő spontán (azaz anélkül, hogy a költségek a külső munka), hogy adja át a hőátadás alatt egy hideg test a meleg, akkor jön a következtetés a lehetőségét egy „örökmozgó a második fajta.” Valóban, legyen egy igazi hőerőgép kap a fűtés hőmennyiség Q1 és Q2 ad a hűtőszekrény hőmennyiséget. Ha ez a munka A = Q1 - | Q2 |. Ha a hőmennyiség | Q2 | spontán telt el a hűtő a fűtő, a végeredmény egy igazi hőerőgép és az „ideális hűtés gép” lenne az átalakulás a munka a hőmennyiség Q1 - | Q2 | nyert a fűtés változás nélkül a hűtőszekrényben.
Így a kombinációja igazi hőerőgép és az „ideális hűtőberendezés” egyenértékű „egy örökmozgó, a második fajta.” Ugyanígy nem lehet bizonyítani, hogy a kombináció a „valódi folyadékhűtő” és a „örökmozgó A második típusú” egyenértékű „az ideális hűtőberendezés”.
A termodinamika második törvénye közvetlenül csatlakozik visszafordíthatatlanságába igazi termikus eljárások. Az energia a termikus mozgás molekulák minőségileg különbözik az összes többi energiaforma - .. mechanikus, elektromos, kémiai, stb Az energia bármely formájának, mellett az energia a termikus mozgás molekulák, lehet teljesen átalakult bármilyen más energia, beleértve az energiát hő-mozgás. Az utóbbi tapasztalhatja konverziós bármely más típusú energia csak részben. Ezért minden fizikai eljárás, amelyben az átalakítás bármilyen típusú energia az energia a termikus molekuláris mozgását visszafordíthatatlan, azaz nem lehet végrehajtani teljesen fordított irányban. A közös jellemzője a visszafordíthatatlan folyamatokat, hogy azok zajlanak termodinamikailag nem egyensúlyi rendszer, és ennek eredményeként ezek a folyamatok zárt rendszer megközelíti a termodinamikai egyensúly.
Alapján bármely készítmények a termodinamika második törvénye, a következő megállapítások tehetők bizonyult, az úgynevezett Carnot-tétel:
1. A hatékonyság egy hőerőgép, működő megadott értékeket a hőmérséklet a fűtő és hűtő, nem lehet nagyobb, mint a hatékonyságát a gép, amely működik a reverzibilis Carnot-ciklus ugyanazokat az értékeket a fűtőtest és a hűvösebb hőmérséklet.
2. A hatékonyság egy hőerőgép szerint működő Carnot-ciklus, nem függ a fajta munkaközeg, hanem csak a hőmérséklet a fűtő és a hűtő.
Így a hatékonysága a gépnek, ami működik a Carnot-ciklus maximális.
Egyenlőség ebben a vonatkozásban megfelel a reverzibilis ciklus. Gépeknél fut a Carnot-ciklus, ez az arány lehet átírni
És melyik irányba Carnot életciklus költség (az óramutató járásával megegyező vagy azzal ellentétes irányban), az értékeket a Q1 és Q2 mindig ellenkező előjelű. Ezért írhat
Ez a kapcsolat lehet általánosítható bármilyen zárt reverzibilis folyamat, ami lehet például egy sor kis izoterm és adiabatikus szakaszok (ábra. 2).

2. ábra: Egy tetszőleges reverzibilis ciklus, mint egy sor kis izoterm és adiabatikus szakaszok
A teljes feltérképezés zárt reverzibilis ciklus
ahol DQi + = DQ1i DQ2i - a keletkező hőmennyiség a működő szervezetben kirajzolja két izotermikus hőmérséklet Ti.
Elvégzésére ilyen bonyolult ciklus reverzibilis módon, a munkaközeg kell eredményeznie hőérintkezés számos hő tározók hőmérséklet Ti. Az arány DQi / Ti nevezett csökkentett hő. Az így kapott egyenlet azt mutatja, hogy a teljes hőt adott semmilyen reverzibilis ciklus nulla. Ez a képlet lehetővé teszi számunkra, hogy egy új fizikai mennyiség úgynevezett entrópia és betűvel jelöljük S (R. Clausius, 1865). Ha termodinamikai rendszer átlép az egyik egyensúlyi állapotból a másikba, hogy megváltoztatja az entrópia. Entrópia különbség a két Államokban adott hő rendszer által kapott reverzibilis átmenet az egyik állapotból a másikba.
Abban az esetben, reverzibilis adiabatikus folyamat DQi = 0, és ezért, az entrópia S változatlan marad. A kifejezés az entrópia változása dS az átmenet az egyik rendszer Bare egyensúlyi (1) egy másik egyensúlyi állapotban (2) felírható
Entrópia határozzuk akár állandó kifejezés, valamint, például, a potenciális energia egy test a erőtér. A fizikai jelentése entrópia DS a különbség a két állam a rendszer. Ahhoz, hogy meghatározzuk a változás entrópia esetében visszafordíthatatlan átmenet a rendszer egyik állapotból a másikba, meg kell gondolni néhány reverzibilis folyamat összekötő kezdeti és végső állapotok, és segítenek megtalálni a csökkentett hő keletkezik, mint egy átmeneti rendszert. Ábra. A 3. ábra a visszafordíthatatlan bővítése a gáz „a void” hiányában a hő. Csak a kezdeti és a végső állapotban a gáz ebben a folyamatban egyensúlyban vannak, és leírhatók a diagramon (p, V). Pontok (a) és (b), amely megfelel ezen államok fekszenek ugyanazon izoterma. Kiszámításához az entrópia változása dS lehetséges legyen egy reverzibilis izoterm átmenet (a) (b). Mivel a izotermikus expanzió a gáz kap egy bizonyos mennyiségű hőt a környező szervek Q> 0, arra lehet következtetni, hogy az irreverzibilis gáz tágulása megnövekedett entrópia: DS> 0.
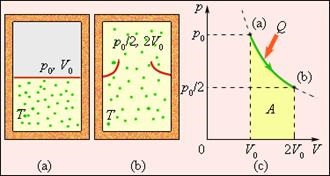
3. ábra bővítése gáz egy „üres”. A változás entrópia
ahol A = Q - munkagáz egy reverzibilis izotermikus expanzió.
Egy másik példa a visszafordíthatatlan folyamat - hő egy véges hőmérséklet-különbség.
Ábra. A 4. ábra két test zárt adiabatikus héj. Kezdeti testhőmérséklet T1 és T2
A növekedés a entrópia egy általános tulajdonsága, az összes spontán előforduló visszafordíthatatlan folyamatokat izolált termodinamikai rendszerekben. A reverzibilis folyamatok az entrópia változatlan marad az izolált rendszerek:

4. ábra: Hőcserélő véges hőmérséklet-különbség: egy - az eredeti állapot; b - a végső állapot a rendszer. A változás entrópia DS> 0.
Ez az arány az úgynevezett entrópia törvénye. Ha bármely folyamatok izolált rendszerek termodinamikai entrópiája akár ugyanaz marad vagy növekszik. Így, az entrópia irányát jelöli spontán előforduló folyamatok. A növekedés entrópia jelzi azt a megközelítést a rendszer termodinamikai egyensúly. Egyensúlyban az entrópia maximális. A törvény a növekvő entrópia lehet venni, mint egy másik megfogalmazása a termodinamika második törvénye. 1878 Boltzmann adott valószínűségi értelmezést az entrópia. Azt javasolta, hogy fontolja meg a entrópia statisztikai mérőszáma rendellenesség zárt termodinamikai rendszer. Minden spontán előforduló folyamatokat egy zárt rendszerben, hozza a rendszer egyensúlyi állapotban, és kíséri növekedése entrópia felé irányulnak növeli a valószínűségét az állam. Minden olyan állapot makroszkopikus rendszer, amely tartalmaz egy nagy számú részecske lehet megvalósítani sokféleképpen.
A termodinamikai valószínűség W rendszer állapota - a szám a módszereket, amelyek ezt az állapotot makroszkopikus rendszer, vagy a számos mikroszkopikus teljesítő ezt macrostate lehet végrehajtani. Definíció szerint, a termodinamikai valószínűsége W >> 1. Például, ha a hajó 1 mól gáz, számos lehetséges módja N molekulák forgalomba két felét a hajó:
Avogadro-szám valahol. Mindegyikük egy mikroállapot. Csak az egyik mikroállamok az esetben, ha az összes molekulák összegyűlnek egyik felében (például, jobbra) a hajó. Annak valószínűsége, hogy egy ilyen esemény szinte nulla. A legnagyobb számú mikroállamok megfelel az egyensúlyi állapotot, amelyben a molekulák egyenletesen oszlanak el a hangerő. Ezért az egyensúlyi állapot a legvalószínűbb. Az egyensúlyi állapot a másik viszont az állam a legnagyobb termodinamikai rendszer zavarainak és a feltétele a maximális entrópia. Boltzmann szerint entrópia S rendszer, és a termodinamikai valószínűsége W kapcsolódik az alábbiak szerint:
ahol k = 1,38 · 10-23 J / K - Boltzmann állandó. Így, az entrópia határozza meg számának logaritmusával mikroállamok, amellyel ez megvalósítható macrostate. Ezért entrópia lehet tekinteni, mint az intézkedés a valószínűsége az állam egy termodinamikai rendszer. Valószínűségi értelmezést második törvény lehetővé teszi, hogy a spontán rendszer eltérést termodinamikai egyensúlyt. Ezek az eltérések az úgynevezett ingadozások. Azokban a rendszerekben, amelyek nagy számú részecske, jelentős eltérés az egyensúlyi állapot rendkívül kis valószínűségű.