termokémiai egyenlet
Hatásainak összehasonlítása különböző energiájú eljárások, hőhatás határozzuk meg standard körülmények között. Egy szabványos befogadó 100 kPa (1 bar), 25 ° C-0 ° C (298 K), a koncentráció - 1 mol / l. Ha a kiindulási anyagok és a reakció termékek standard állapotban, a standard képződési entalpia nevezik a standard entalpiája a rendszer és a jelölt ΔN0298 vagy ΔN0.
Az egyenletek a kémiai reakciók jelezve a termikus hatás nevezzük termokémiai egyenletek.
A termokémiai egyenletek azt mutatják, a fázis állam és egy polimorf reakcióra és alkotó anyagok -gáz r, W - folyadék -kristallicheskoe, t - szilárd, p - oldjuk, stb Ha a halmazállapot az anyagok a reakciókörülmények között könnyen nyilvánvalóvá, például az O2, N2. H2 - gázok, Al2O3, CaCO3 - szilárd anyagok, stb 298 K, akkor el lehet hagyni.
A termokémiai egyenlet tartalmaz egy termikus hatás? H reakciót. amely modern értelemben követően van rögzítve az egyenletet. Például:
A termokémiai egyenletek működhet, mint algebrai egyenletek (összeadás, kivonás egyik a másik, szorozva egy konstans, stb).
A termokémiai egyenlet gyakran (de nem mindig) biztosítunk egy mol a szóban forgó anyag (vagy áldozati kapunk). Azonban más résztvevők beléphetnek az egyenlet frakcionált együtthatók. Ez lehetővé tette, mert a termokémiai egyenlet nem működik a molekulák és anyagok mol.
termokémiai számítások
Standard képződési entalpia határozza kísérletesen és egy termokémiai számítások.
A termokémiai számítások alapján a törvény Hess (1841):
Reakcióhő független a módot, ahogyan a reakció megy végbe (vagyis azt a számot a közbenső szakaszok) által meghatározott, a kezdeti és a végső állapotban a rendszer.
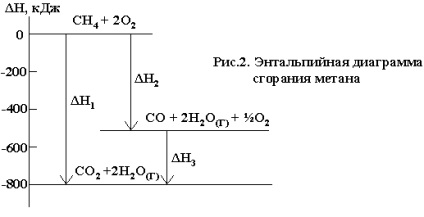
Például, a metán égési reakció végbemehet a következő egyenlet szerint:
Ugyanezt a reakciót végezzük el a lépést képződése CO:
Kiderült, hogy ΔN01 = ΔN02 + ΔN03. Következésképpen, a reakcióhő, átfolyik a két út ugyanaz. Hess jól szemlélteti az entalpia diagramok (2. ábra)
és
1. A termikus hatása a határidős reakció a termikus hatás a fordított reakció az ellenkező jel.
2. Ha a több egymást követő kémiai reakciók, a rendszer eléri a állapotban megegyezik az eredeti, akkor az összeg a hőhatás ezen reakciók nulla (? H = 0). Eljárások, amelyekben a rendszer az egymást követő transzformációk visszaáll nevezzük cirkuláris eljárások vagy ciklusok. ciklus módszert széles körben használják termokémiai számítások.
3. A entalpiája a kémiai reakció az összege a képződéshő a reakció termékek kevésbé összege a képződéshő a kiindulási anyagok figyelembe véve a sztöchiometrikus együtthatók.
Itt találkozunk azzal a gondolattal 'entalpiája formáció”.
Entalpia (hő) képező kémiai vegyület az úgynevezett termikus hatása a reakció 1 mol vegyület egyszerű anyagok, hozott azok állandósult állapotban ilyen körülmények között. Jellemzően, a képződéshő utal, hogy a standard körülmények, azaz, 25 0 C (298 K) és 100 kPa. A standard képződési entalpia vegyszerek jelöljük ΔN0298 (vagy ΔN0) mért kJ / mól, és tartalmazott kézikönyvekben. A entalpiája képződése egyszerű anyagok. stabil 298 K, a nyomás pedig 100 kPa, vesszük nullával egyenlő.
Ebben az esetben a következménye, Hess-féle törvény standard képződési entalpia (.? H (H.R)) a formája: