Laboratóriumi munka №5 egyenértékű
Egy anyag ekvivalense az annak mennyisége, amely 1 mól hidrogénatomhoz kapcsolódik, vagy pedig kémiai kölcsönhatásokban helyettesíti.
Egy anyag ekvivalensének móltömege az anyag egy ekvivalensének tömege; az anyag móltömegének kiszámításánál az anyag egyenértékű számával oszlik meg.
Az ekvivalensek törvénye szerint az anyagok kölcsönhatásba lépnek egymással az egyenértékűkkel arányos mennyiségben. Ezért bármely anyag ekvivalensének móltömege megtalálható egy másik anyaggal való kölcsönhatásból, amelynek ismert móltömege ismert.
Ehhez a laboratóriumi munkához a következő reagensekre van szükség:
2. Sósav-sósav;
3. CaCO3 kalcium-karbonát.
A laboratóriumi beavatkozásra vonatkozó kérdések:
1. Az egyenértékű jogszabályok megfogalmazása.
2. Mi a megfelelő?
3. Mi az egyenértékű szám?
4. Hogyan találjuk meg az egyenértékű egyszerű anyag mennyiségét?
5. Hogyan lehet megtalálni egy megfelelő számú oxidot?
6. Hogyan lehet megtalálni az ekvivalens hidroxidszámot?
7. Hogyan lehet megtalálni az egyenértékű savakat?
8. Hogyan lehet egyenértékű sót találni?
Tapasztalat száma 1. Az alumínium egyenértékének moláris tömegének meghatározása
A gázkibocsátással járó reakciókban az egyenértékű anyag moláris tömegét volumetrikus módszerrel határozhatjuk meg - a kifejlődő gáz térfogatával.
A tapasztalat technikája. A pour cső 5,6 ml oldatban, sósav HCI és tegye alumínium csövek edge Al lemérjük úgy, hogy a fém nem érintkezik egy savval. Ezután csatlakoztassuk a csövet a készülékhez a gázmennyiség meghatározásához - két üvegből álló, vízcsővel töltött üvegből áll, melyet a kommunikációs hajók típusai összekapcsolnak. Miután a kémcső vízszintjét jelöltük meg, amelyhez a kémcső csatlakoztatva van, a fém mintát a savba dobjuk. A reakció során gáz-halmazállapotú anyag szabadul fel, és a cső vízszintje, amelyhez a kémcső csatlakozik, csökken. Amikor a vízszint a csőben stabilizálódik, befejezzük a kísérletet.
A kísérlet során a következő reakció lép fel:
Írja le a kezdeti adatokat az alumínium egyenértékének moláris tömegének kiszámításához az alábbi mintázat szerint:
A minta súlya m, g;
A felszabadított hidrogén térfogata V, ml;
A kísérlet hőmérséklete t, ° C;
A légköri nyomás P, mm Hg. Art. ;
A vízgőz rugalmassága h, mm Hg. Art.
A rendes körülmények között felszabadított hidrogén térfogatát a következő képlet segítségével hozhatjuk létre:
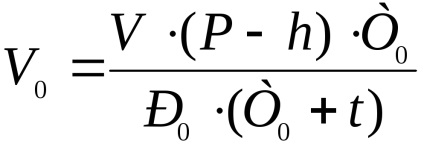
ahol V a kibocsátott hidrogén térfogata, ml;
P - atmoszferikus nyomás, mm Hg;
t a kísérlet hőmérséklete, ° C;
h a vízgőznyomás a kísérleti hőmérsékleten, mm Hg;
T0 a normál körülményeknek megfelelő hőmérséklet, K;
P0 a normál körülményeknek megfelelő nyomás, mm Hg.
Feljegyezzük a felszabadított hidrogén térfogatának a fenti képlet szerinti normál körülmények közötti csökkenésének kiszámítását, figyelembe véve a kapott kezdeti adatokat.
Számítsuk ki az alumínium egyenértékének moláris tömegét a következő képlet segítségével:
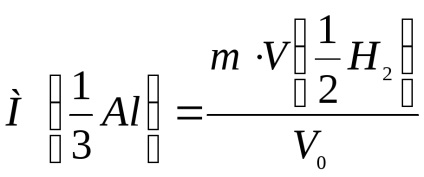
ahol m a minta súlya, g;
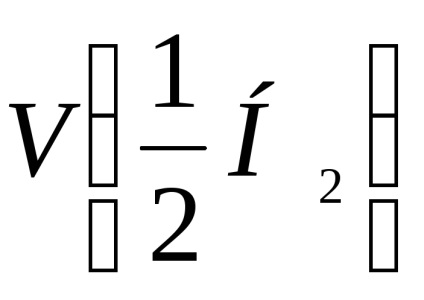
V0 a kibocsátott hidrogén térfogata normál körülmények között, ml.
Írja le az alumínium egyenértékének moláris tömegét a fenti képlet szerint.
A kísérlet relatív hibáját a következő képlet adja meg:
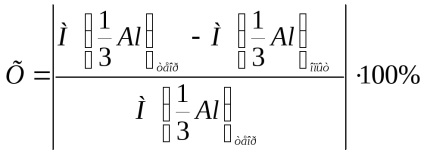
ahol
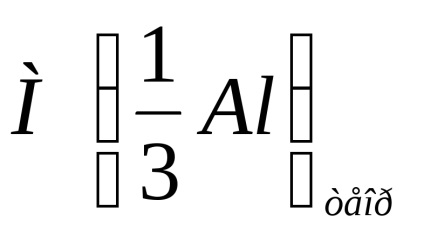
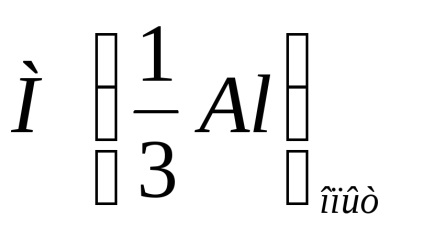
Írja le a kísérlet relatív hibájának kiszámítását a fenti képlet segítségével.
Végezd el ezt a módszert az anyag ekvivalensének móltömegének meghatározására, és jelezd, milyen hibát találtál ebben az esetben.
A tapasztalat száma 2. A kalcium-karbonát ekvivalensének móltömegének meghatározása
Az anyag egyenértékének móltömegét a másik anyag pontosan ismert mennyiségével reagáltatandó anyag mennyiségéből határozhatjuk meg.
A tapasztalat technikája. A ampullába mintát márványból (kalcium-karbonát CaCO3), és adjunk hozzá 4 ml (0,004 dm 3) HCI sósavoldatban moláris ekvivalens koncentrációja 0,5 mol / dm 3.
A kísérlet során a következő reakció lép fel:
A gázkibocsátás megszűnése után a maradék márványdarabot mossák, szárítják és lemérik.
Számítsuk ki a sósavval reagáltatott kalcium-karbonát tömegét az alábbi képlet szerint:
ahol m1 a minta kezdeti tömege, g;
m2 a minta végső tömege, pl.
Jegyezzük fel a kalcium-karbonát tömegét, amelyet sósavval reagáltatunk, a fenti képlet szerint.
Számítsuk ki a kalcium-karbonát ekvivalensének móltömegét az alábbi képlet szerint:
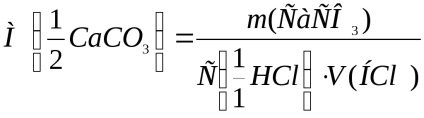
ahol m (CaCO3) a sósavval reagáltatott kalcium-karbonát tömege;
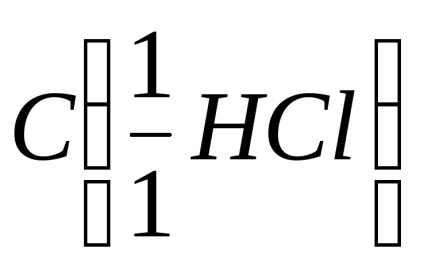
V (HCl) - sósav térfogata, dm3.
Feldolgozzuk a kalcium-karbonát ekvivalensének moláris tömegének kiszámítását a fenti képlet szerint.
A kísérlet relatív hibáját a következő képlet adja meg:
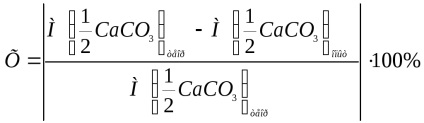
ahol
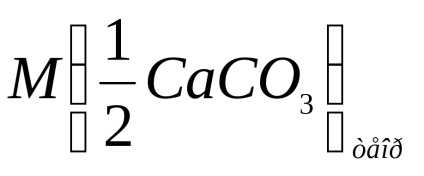
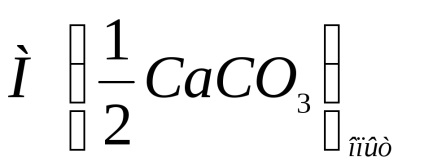
Írja le a kísérlet relatív hibájának kiszámítását a fenti képlet segítségével.
Végezd el ezt a módszert az anyag ekvivalensének móltömegének meghatározására, és jelezd, hogy milyen hibát találtunk ebben az esetben.
A laboratóriumi munka védelmére vonatkozó kérdések:
1. Milyen mértékben függ az ekvivalens kémiai kölcsönhatások száma?
2. Hogyan lehet megtalálni az egyenértékű ioncserélési folyamatot?
3. Hogyan találjuk meg az oxidációs redukciós folyamatok megfelelő számát?
4. Mi az egyenértékűségi tényező?
5. Hogyan találhatom meg az egyenértékű anyag moláris tömegét?
6. Hogyan találjuk meg a reakcióban részt vevő anyag ekvivalensének moláris tömegét?
7. Hogyan találom meg az anyagmérlegek mennyiségét?
8. Hogyan számolhatom ki a gáznemű anyag ekvivalensének moláris térfogatát?
9. Milyen mennyiségek fognak normál körülmények között egy ekvivalens hidrogént és egy ekvivalens oxigént?
1. N.L. Glinka. "Általános kémia." Az "Egyenértékű" fejezet. Az egyenértékűek törvénye ".
2. E.M. Rybalkin, O.Yu. Kovalik. „Chemistry. Oktatási vizuális segítség ". Az "Egyenértékű" fejezet.
3. R.M. Belkina, V.D. Ivanova. „Egyenértékű. Egyenértékű tömeg. A gyakorlati képzés feladatai. "