Módszertani utasítások
Az "Aromás szénhidrogének" témájú elméleti javaslatokat ismertetik. Az aromás szénhidrogének meghatározása, valamint az "aromásság" fogalma. A benzolmolekula szerkezetét ismertetjük. Az egyetlen benzolmaggal rendelkező aromás vegyületek nómenklatúráját és izomerizmusát tekintjük. Az arén megszerzésének legfontosabb módszerei, az aromás szénhidrogének fizikai és kémiai tulajdonságai is.
A PSM, FHC, BSC, BTP és AS teljes munkaidős és részmunkaidős képzési formái első és második évének hallgatóira számítva.
Fordítók: Cand. Chem. Sciences, Assoc.
cand. Chem. Tudományok, Assist.
Áttekintő: Cand. Chem. Sciences, Assoc.
Az aromás vegyületek (arénok) olyan szerves vegyületek, amelyeknek sík ciklikus szerkezete van, amelyben minden szénatom egy egyetlen delokalizált π-elektron rendszert alkot, amely (4n + 2) π-elektront tartalmaz.
Az aromás vegyületek elsősorban a benzol C6H6 és számos homológja és származéka. Az aromás vegyületek tartalmazhatnak egy vagy több benzol magot (többmagos aromás vegyületek) a molekulában. De az aromás vegyületeket egy benzol maggal vesszük figyelembe.
A benzolmolekula szerkezete
A benzolt Faraday M. 1825-ben fedezte fel könnyű (koksz) gázban, és a benzolmolekula szerkezete leggyakrabban a német kémikus A. Kekule (1865)

A modern fogalmak szerint a benzolmolekula lapos hatszög alakú, amelynek oldala egyenlő egymással és 0,14 nm-es. Ez a távolság az átlagos érték 0,154 nm (egykötéshossz) és 0,134 nm (kettős kötéshossz) között. Nem csak a szénatomok, hanem a hozzájuk kapcsolódó hat hidrogénatom is ugyanabban a síkban helyezkednek el. A H-CC és CC-C kötések által képzett szögek 120 °:
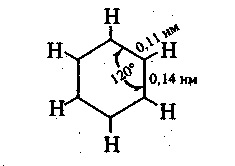
A benzolmolekula összes szénatomja a sp2-hibridizáció állapotában van. Mindegyikük három hibrid pályájával van összekötve, két ugyanolyan orbitálisan két szomszédos szénatomot és egy H atom orbitálisát, három σ-kötést alkotva (lásd az ábrát). A szén azon negyedik, nem hybridizált 2p-orbitálisa, amelynek tengelye merőleges a benzolgyűrű síkjára, átfedi a jobb és bal oldali két szomszédos szénatom hasonló orbitálisát.

A σ-kötések és π-kötések képződésének módszere a benzolmolekulában
Ez az átfedés a benzolgyűrű felett és alatt helyezkedik el. Ennek eredményeként egy π-elektronok egyetlen zárt rendszere jön létre. Ennek eredményeképpen az összes hat szénatomos 2p-orbitálisok egységes átfedése eredményeképpen egyszerű és kettős kötések "összehangolása" következik be. a benzolgyűrűben nincsenek klasszikus kettős és egyszeres kötések. A π-elektronsűrűség egyenletes eloszlása az összes szénatom között, a π-elektronok delokalizációja miatt, oka a benzol molekula nagy stabilitásának. Jelenleg nincs egyetlen módja annak, hogy grafikusan ábrázolják a benzol molekulát, figyelembe véve annak valós tulajdonságait. De annak érdekében, hogy hangsúlyozzuk a π-elektronsűrűség kiegyenlítését a benzolmolekulában, a következő képleteket alkalmazzuk:
Mindemellett emlékeztetni kell arra, hogy ezek a formulák egyike sem felel meg a molekula tényleges fizikai állapotának, sokkal kevésbé tükrözi a tulajdonságainak sokféleségét. A Kekule-formula jelenleg csak a benzolmolekula szimbóluma. Azonban széles körben használják, emlékezve a hiányosságaira.