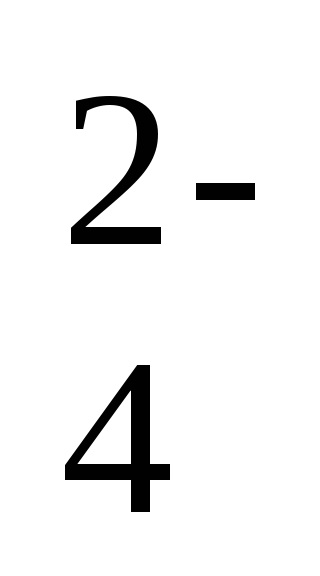Ioncserélő reakciók az ionok között elektrolit oldatokban
Az elektrolit oldatainak reakciói ionok között fordulnak elő, amelyekhez az oldott anyagok disszociálódnak. Ugyanakkor az elemek oxidációs állapota nem változik.
Nem minden ioncsere-reakció visszafordíthatatlan. Az ioncserélő reakciók véget érnek, ha a reakció eredményeképpen a következők keletkeznek:
-oldhatatlan vegyület kicsapódik;
-gyenge elektrolit (víz, gyenge bázis vagy gyenge sav).
-- Az ilyen típusú reakciók egyenletei helyesen íródnak nem molekuláris, hanem ionmolekuláris formában. Ezekben az egyenletekben jelzik azokat az ionokat, amelyekbe az erős elektrolitok molekulái bomlanak. Az oldatból csapadék formájában felszabaduló, kevéssé oldódó anyagok, gáznemű vegyületek és gyenge elektrolitok molekuláris formában vannak leírva. Ezenkívül a reakcióegyenlet rövid, ionos formája van, amely tükrözi az elektrolit oldatban lejátszódó reakció jellegét.
Példák a visszafordíthatatlan reakciókra
1. Az üledék képződése
- molekuláris reakcióegyenlet,
Ba 2+ + 2Cl - + 2Na + + SO
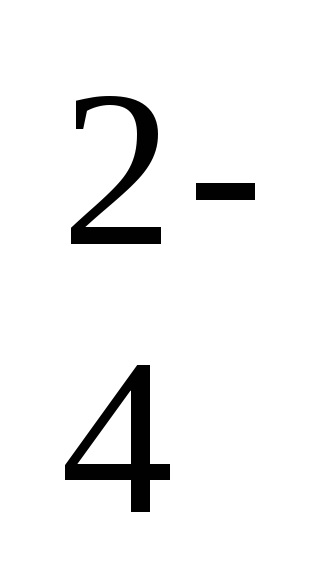
- a reakció ion-molekuláris egyenlete,
Ba 2+ + SO
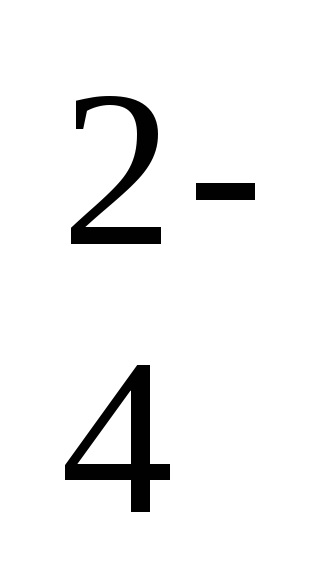
2. Gáznemű anyag képződése
- molekuláris reakcióegyenlet,
2Na + + S 2- + 2H + + 2Cl - = H2S ↑ + 2Na + + 2CI -
-a reakció ion-molekuláris egyenlete,
2H + + S 2- = H2S ↑ a reakcióegyenlet rövid formája.
3. Gyenge elektrolit képződése
a) Víz: 2NaOH + H2S04 = H20 + Na2S04 - a reakció molekuláris egyenlete,
2Na + + 2OH - + 2H + + SO
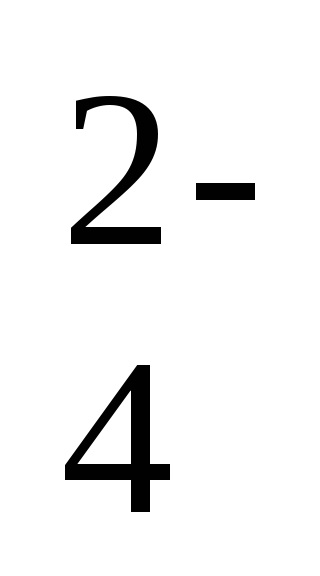
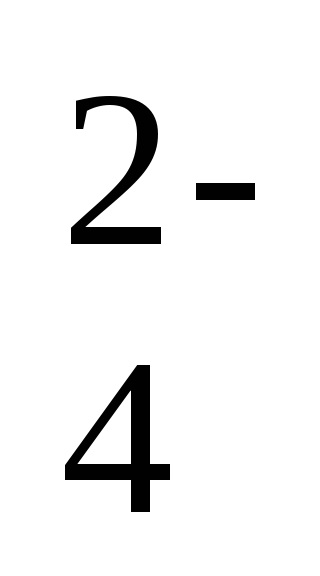
-a reakció ion-molekuláris egyenlete,
2OH - + 2H + = 2H20 - a reakcióegyenlet rövid formája.
Az erős sav semlegesítése erős bázissal a hidrogénionok és a hidroxidionok kölcsönhatására redukálódik.
b) Gyenge sav:
- molekuláris reakcióegyenlet,
2Na + + 2NO2- + 2H + + SO
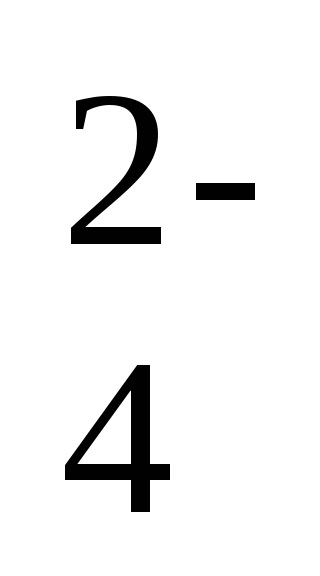
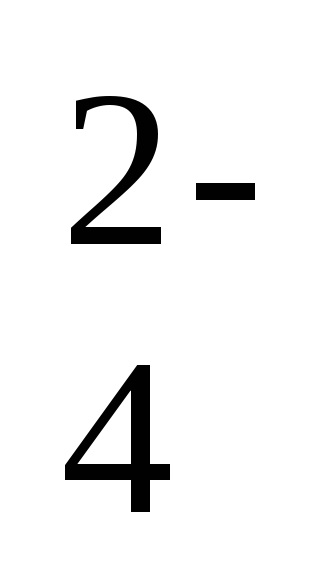
-a reakció ion-molekuláris egyenlete,
2H + + 2NO2 - = 2HNO2 - a reakcióegyenlet rövid formája.
Erős savak kiszorítják a gyenge savakat sóikból.
c) Gyengeség:
NH4Cl + NaOH = NH40H + NaCl
- molekuláris reakcióegyenlet,
NH4 + + Cl - + Na + + OH - = NH4OH + Na + + Cl -
-a reakció ion-molekuláris egyenlete,
NH4 + + OH - = NH4OH - a reakcióegyenlet rövid formája.
Erős bázisok kiszorítják a gyenge bázisokat sóikból.
Amfoter-hidroxidok
Az amfoter-hidroxidok a Me (OH) n típusú vízben oldhatatlan vegyületek. amelyek kölcsönhatásba lépnek mind a savas oldatokkal, mind a lúgok oldatával. A savas oldatokkal reagálva alapvető tulajdonságaik vannak:
A lúgok oldatával reagálva savas tulajdonságokkal rendelkeznek, így hidroxikomplex vegyületeket képeznek:
Oldhatósági termék
Teljesen oldhatatlan anyagok ott. A legtöbb szilárd anyag korlátozott oldékonysága. A telített oldatok elektrolitok nehezen oldódó anyagok egy dinamikus egyensúlyi állapot és a csapadékot telített elektrolit oldatban. Például egy bárium-szulfát telített oldatában, amely az anyag kristályaihoz kapcsolódik, dinamikus egyensúlyi helyzet alakul ki: BaSO4 (t) ⇄ Ba2 + (p) + SO
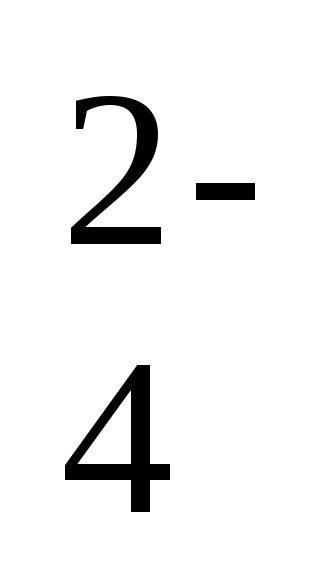
Ehhez az egyensúlyi folyamathoz az egyensúlyi konstans kifejezést írhatjuk ki, figyelembe véve, hogy a szilárd fázis koncentrációja nem szerepel az egyensúlyi konstans kifejezésben: Kp = [Ba 2+] [SO
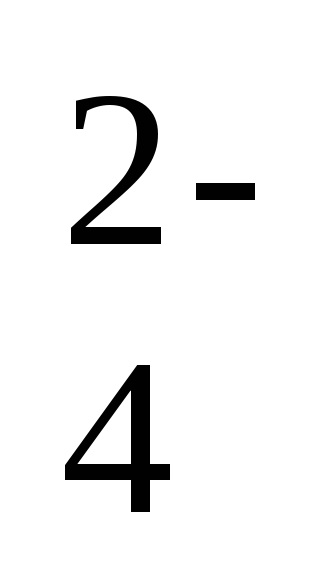
Ezt a mennyiséget egy enyhén oldódó anyag (OL) oldható termékének nevezik. Így egy rosszul oldódó vegyület telített oldatában az ionjainak koncentrációjának terméke a sztöchiometrikus együtthatók mértékében megegyezik az oldható termék értékével. A vizsgált példában a PR (BaS04) = [Ba2 +] [SO