Virtuális nyomvonalak valódi gyógyszerek
A fő támogatója a verseny - a előrelátó cég Genotek.
A verseny által támogatott OJSC „RVC”.
Támogatója a kategóriában „bioinformatika” az Intézet Bioinformatikai. Támogatója a közönségdíjas készült cég Helikon. A díja is bemutatja az alapítvány támogatása a fejlett biotechnológia.
Nem mindig a legjobb eredményeit számítógépes szimuláció ( «in silico» [1]) molekula - gyógyszerjelöltként - lehet egy „csodálatos pirulát”, például miatt oldhatatlanságuk sztérikus (térbeli) korlátozások kötődés a cél molekula ( általában fehérje) vagy védelmére vezető szabadalom. Még ilyen körülmények között a lehetséges gyógyszer nem klinikai vizsgálatok során, mert a problémák a szállítás az érintett szöveteket és szerveket. Túl hamar, hogy lebontják és kiürül a szervezetből, nem a cél elérését. Keresztreakció - egy másik probléma, hogy a gyógyszerek. Ez azon a tényen alapul, hogy a molekulák potenciális gyógyszerek gyakran kölcsönhatásba nem csak a várt célt nekünk, hanem más fehérjék a szervezetben. Ebben az esetben a mellékhatások lehetnek még veszélyesebb, mint maga a betegség.
Modern gyógyszerek kifejlesztése és a kábítószer-tervezés
Kábítószer-design, vagy racionális tervezése gyógyszerek - aktívan fejlődő utóbbi kutatási terület. Az alapok ebben az irányban jól lefektetett orosz cikke és az Anton Chugunov „Drag-design: hogy a világon ma az új gyógyszerek” [2]. Számos betegségnél nem kellően hatékony gyógyszer, az út molekulajelölt a gyógyszerpiaci tíz évig tart, és hozzanak létre egy kábítószer értéke több milliárd dollárt [3]. Adatbázisok (például, pubchem. ChEMBL. Cink) tartalmaznak több tízmillió kémiai vegyületek. Kísérlettel ellenőrizni, hogy az egyes hatóanyag-molekula olyan betegségben - szinte lehetetlen feladat. Ezért szükséges, hogy végezzen az elsődleges szűrés ebben a hatalmas térben vegyi «in silico». alapján szerkezetéből és ismert tulajdonságait. Erre a sok különböző megközelítések, például molekuláris dokkolási [4] és molekuláris dinamikáját [5]. Molekuláris dokkoló - molekuláris szimulációs módszer, amely lehetővé teszi, hogy előre a legjobb helyzetben a ligandum (általában egy kis molekula) képest a célfehérjéhez segítségével a háromdimenziós szerkezetét és teljesítményét az energia függvényében a kölcsönhatás a molekulák. Molekuláris dinamika alapul potenciális energia kiszámítására egyenleteket a mozgás az atomok és empirikus funkcióit atomközi kölcsönhatások és leírják az evolúció a molekuláris rendszer időben.
választása célok
Mielőtt keresni gyógyítja a betegséget, meg kell érteni a molekuláris alapját annak fejlődését. Felfedezni az okokat, és megtudja, mi a kölcsönhatás fehérjék gombot. Így lehet leírni a fejlesztés a betegség molekuláris szinten keresztül kaszkád reakciók *. Erre azért van szükség, hogy melyik fehérje a legígéretesebb célokat (a célok, hogy cselekednünk kell kijavítani vagy kompenzálni a megsértése, amely miatt a betegséget).
* - By the way, a modern rendszerek biológia gyakorlat felvétel reakcióinak szakaszban és minden hierarchia biokémiai és biológiai folyamatok egyre gyakoribb. [6] - Szerk.
Mit kell figyelembe venni modellezésére, illetve hogyan kanyargós ösvényeket hozott
Azt képzeljük, hogy a számítási teljesítmény hihetetlenül magas, és tudjuk tesztelni, értékeli a kötési energia, hogyan befolyásolja a szinte az összes ismert kis molekula protein cél (valójában ez nem így van). Tegyük fel, hogy ennek eredményeként a felülvizsgálat, már kiválasztotta a molekulák száma, amelyek kimutatták, hogy a legjobb eredményt. Gondolod, hogy minden válhat gyógyszerek? A kérdés megválaszolásához, ne végezzen kísérleteket sejtekkel, sőt a test, amit tovább kell tesztelni silico. Emlékezzünk arra, hogy egy kis molekula meg kell felelniük az empirikus eredetű „szabály az öt” Lipinski (kevesebb, mint öt donoratom hidrogénkötés, a molekulatömege kisebb, mint 500; van lipofil (log P - anyag eloszlási koefficiens a víz-oktanol megoszlási) kevesebb, mint 5; nem több, mint 10 nitrogénatomot és oxigén) [2]. Sem lehet elfelejteni a metabolikus jellemzői (ADMET: felszívódás, eloszlás, metabolizmus, kiválasztás, toxicitás). Mindezek mellett, az szükséges, hogy a jelölt molekula képes volt kölcsönhatásba térben az aktív központ a cél, és kielégítik a sztérikus korlátok. Lehet, hogy az aktív molekula az esetlegesen túl nagy, ezért nem „kap”, hogy az aktív hely a cél, vagy egy bonyolult szerkezet, ami miatt nagyon nehéz és költséges szintetizálni. Egy másik változat szerint a molekula nagyon kicsi, és „univerzális” -, akkor kölcsönhatásba nem csak a célokat, hanem sok más fehérjék az emberi szervezetben. Ez ahhoz vezet, hogy a mellékhatások, amelyek nagyon súlyosak lehetnek. A kép nem túl boldog, és ahogyan a gyógyszerek a piacon annál zavaros. „Mivel minden görbéket rajzolt előttem, süket kanyargós ösvényeket.” - szerinti Yosano Akiko, egy japán költő. Nos, vannak olyan módon, hogy segítsen a félreértések elkerülése végett ezekben kanyargós ösvényeket húzza design.
Változás csontváz
Ha megtalálta a molekula gyógyszerjelöltekel, meg kell optimalizálni és javítani annak tulajdonságait, hogy növeljék a siker valószínűsége kísérleti ellenőrzése. Figyelembe véve a jelölt molekula (ligandum), azonosítani tudjuk fontosnak, hogy kölcsönhatásba lépnek a cél fehérje része a szerkezeti váz - a csontváz - és más csoportok, feltehetően nem vesz részt a kölcsönhatásban érdekes számunkra, vagy akár megakadályozni a kapcsolatot a célligandummai. Megváltoztatása a csontváz (állvány hopping) van szükség, ha meg akarjuk menteni fontos kölcsönhatás a cél a ligandum és a másik helyére megfelelőbb. Természetesen szükség van ebben az esetben figyelembe kell venni a változás ligand kötési energia a cél. Ezen túlmenően, a konformációs tulajdonságait a ligandum megváltoznak, ami befolyásolja az entrópia kölcsönhatást.
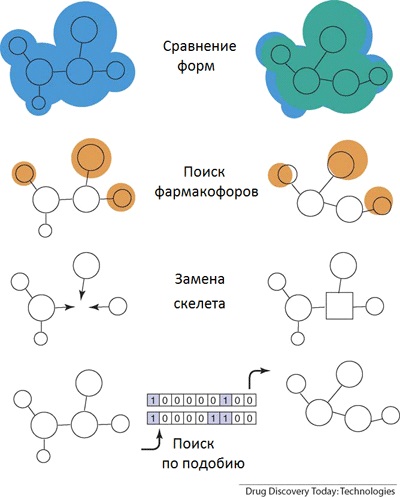
1. ábra: A elve „csontváz shift„: a véletlen formák, keressen bizonyos csoportok, amelyek meghatározzák a tulajdonságait a csontváz maga a változás, a hasonlóság keresési. Kép [11].
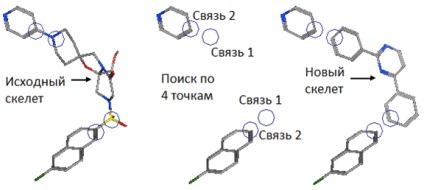
2. ábra A kiindulási molekula és a molekula - az eredmény a változása a csontváz. Kép [12].
Ha megváltoztatja a csontváz kapunk egy csomó új lehetőségeket, amelyek közül kiválasztjuk a legjobb, legmegfelelőbb számunkra háromdimenziós szerkezetét, az entrópia kötési energia a cél fehérje, és egyéb jellemzőit. Változás ligand csontváz bővíti körünkbe lehetőségeket ad sok változatban. Mintha már egy sor designer darabokat, és azt akarjuk, hogy gyűjtsenek néhány rendezett és stabil szerkezet (használata fragmentumok és néhány link őket), majd csatolja mást. Mintha elvesztette egyik utolsó darab a puzzle, de tudjuk, hogy mi legyen a hely, amelyhez csatolni kell a képet, így téve teljessé. Így tudjuk, például a nagy és trudnosinteziruemogo ligand, hogy egy kicsi, jól képes arra, hogy az utat a kötőhely. Mint egy karton kivágott egy hiányzó darab a puzzle, elöntve minden felesleges.
Van egy másik érdekes alkalmazás, csontváz műszakban járó úgynevezett előrenyomuló szabadalmat. Ezeket a szabadalmakat ki egy ideig igénylő vállalatok az a kábítószer jelenléte egy adott tevékenység a molekula. Ahogy kell bizonyítani, hogy ez a tevékenység valóban ez idő alatt. És mit csinálsz, ha talált magának a tevékenység e molekula és szeretné szabadalmaztatni? Ha egy változás a csontváz, az eredmény egy másik molekula, nem zárt a szabadalom, de mivel érdekes biológiai aktivitást [7, 9-11].
Hasonló molekulákhoz farmakoforokat
Farmakofor - egy sor térbeli és elektronikus funkciók szükségesek az optimális kölcsönhatások biológiai célpont okozhat, vagy blokkolja a biológiai választ. Az ilyen funkciók lehetnek hidrofobicitás, aromásság, donor-akceptor tulajdonságait a töltés. Tudjuk használni a keresést farmakoforjára a virtuális (számítógép) szűrés nagy adatbázisok, könyvtárak kémiai vegyületek. Ez különösen hasznos megközelítés, amikor nincs elég információ a szerkezet a cél, és egy sor ligandumok használatáért modellezési technikák alkalmazásán alapuló háromdimenziós struktúrákat.
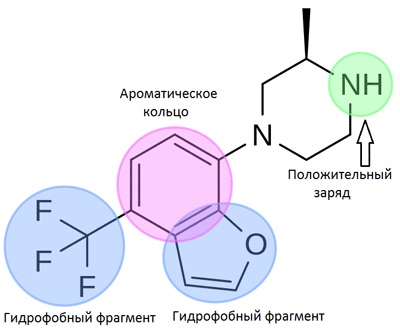
4. ábra példa egy háromdimenziós farmakofor modellt. Kép Wikipedia.
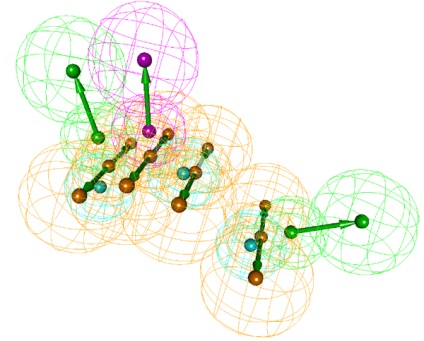
5. ábra: Eredmények molekuláris hasonlóságuk. Kép: kézi WODCA.
Keresés a molekuláris hasonlóság
A szerkezetileg hasonló molekulákat jellemzően rendelkeznek hasonló biológiai tulajdonságokkal. Ez a molekuláris elve a hasonlóság. Tegyük fel, tudjuk, hogy egy bizonyos tevékenység a ligandum kölcsönhatásban van egy cél, de különböző okok miatt (a kölcsönhatás egyéb fehérjék a szervezet és a toxicitás, csökkent ADMET tulajdonságok, szabadalmi oltalom) nem lehet használni a számunkra, mint egy új gyógyszer. Akkor lehet keresni a kép, és megtalálni a megfelelő iigandummoiekuiák, amely aztán nagyobb valószínűséggel válnak gyógyszer.
Következtetés, illetve, hogy megtudjuk, hogy hozzon létre egy kúra?
Egy példa az integrált megközelítés a kábítószer-tervezés munkája Bergman és kollégái, amely az úgynevezett «SHOP: vázszerkezet hopping GRID-alapú hasonlósági keresések» [16]. Az alkalmazott módszerek a csontrendszeri változások hasonlóság keresési molekuláris dokkoló és néhány matematikai számítások. A célokat a demonstrációs a módszer vettünk trombin, a HIV-1 proteáz és neuraminidáz (fehérjét virális membrán, amelynek az enzimatikus aktivitása, egyik kulcsfontosságú fehérjék az influenza-vírus és a jó célpont a húzás tervezési, keresés mert inhibitorok kezdődött 1966). A teremtés gyógyszerek fontos szerepet játszik a szerencse, esély és a valószínűség. Ezért tudjuk használni a fejlettebb technikák és a „fondorlatos útját”, amikor „kitalálni” a jelölt molekula nem tökéletes. Látjuk, hogy tudjuk, hogy jobb, szeretnénk még valamit, és ezt el tudjuk érni.
„A felfedezés - ez olyan, mint beleszeretni, és hogy elérje a hegy tetején, miután a nehéz. „- mondta Max Ferdinand Perutz, angol biokémikus, Nobel-díjat 1962-ben. [8]
köszönöm
Pete Vlasov, hogy felfedje, hogy nekem a lehetőséget, hogy vegyenek részt a drag tervezés; Natalya Kireeva, hogy az olvasás előadások különböző cheminformatics a MIPT (PG); Fjodor Kondrashov és Dinara Usmanova, hogy inspirálja, hogy tegyek tudomány.
további irodalom
irodalom
Ön is érdekelt
Mivel a kőkorszaki, és az is maradt nagyjából megegyezik a XIX században, az emberi népesség - olyan helyzetben, amikor a két szülő két gyerek túléli a reproduktív korban. Túléli - általában születik egy tucat, de a legtöbb elpusztult kibocsátása nélkül - a klasszikus természetes szelekció elmélete. Ugyanakkor, az emberek ritkán halnak szemfogai farkasok vagy a tigrisek - a legtöbb halálesetet okozott betegség, az arc, amit éppen olyan védtelen, mint „a mi kisebb testvérek”. Addig, amíg az Advent a vakcina. Ebben a cikkben nem fogjuk ásni az elmélet immunizálás, és helyette megpróbálok válaszolni emberi nyelven, hogy foglalkozzon az emberek kérdéseket védőoltásokat.