Aminok és aminosavak
Aminok - nitrogéntartalmú szerves anyagokat, amelyek ammóniából (NH3), a molekulák, amelyek egy vagy több hidrogénatom helyettesítve van egy szénhidrogéncsoport (- R vagy - C nH 2n + 1)
Funkcionális csoport: - NH2 aminocsoport
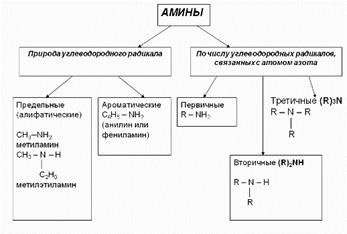
Nómenklatúra aminok 1. A legtöbb esetben, aminok képezik neveknek a nevét szénhidrogéncsoport és a toldalék amin.CH3 Metil-amin-NH2 CH3-CH2-NH2 Etilamin különböző csoporttal ábécésorrendben. CH3-CH2-NH-CH 3 metiletilamino
Ha vannak azonos gyökök segítségével di konzolok és három. (CH 3) 2NH Dimetilamin
2. Primer aminok gyakran nevezik származékai szénhidrogén molekulák, amelyekben egy vagy több hidrogénatom helyettesítve van aminocsoport -NH2. Ebben az esetben, az amino-csoport az amin feltüntetett utótag név (egy csoport -NH2), etilén-diamin (két -NH2 csoportok), stb azzal a kiegészítéssel, számok, tükrözve a helyzetben ezek a csoportok a fő szénláncban.
Például: CH3-CH2-CH2-NH2 propánamin-1H2N-CH 2-CH 2-CH (NH 2) -CH 3 1,3-bután-diamin
6. aminovStrukturnaya izoméria izoméria
- a szénváz, hiszen S4H9NH2:
- amino izoméria kapcsolatos változások a szubsztitúciós foka a hidrogénatom az a nitrogén, azaz típusai között aminok:
Aminok előállítása. Az alacsonyabb szag aminok hosszú idő szükséges ammóniát, míg a francia kémikus Charles Wurtz nem találhatók 1849 évben, szemben ammónia levegővel égnek, hogy szén-dioxid. Azt szintetizált a metil és etil-amin.
R-NO2 + 6 [H] t, Kat-Ni → R-NH2 + 2H2O R-NO 2 + 3 (NH4) 2S t, Fe savas közegben → R-NH2 + 3S ↓ + 6NH3 ↑ + 2H2O
Más módon: 1). Ipari CH3Br + 2NH3 t, ↑ p → CH3-NH2 + NH4Br
2). Laboratóriumi - cselekvési alkálifémsóit alkilammónium [R-NH3] D + NaOH T → R-NH2 + + H2O Nag
3). Hatás a primer alifás halogén-alkánok és aromás aminypoluchayut szekunder és tercier aminok, ideértve a vegyes.
8. Fizikai tulajdonságai aminok.
Közönséges hőmérsékleten csak a rövid szénláncú alifás aminok CH3NH2, (CH 3) 2NH és (CH 3) 3N - gázok (ammónia szag), homológjait közepes - folyékony (éles halszagú), a magasabb - szilárd anyagok szagtalanok. Aromás aminok - színtelen folyadék forráspontja vagy szilárd veschestva.Aminy kialakítására képes hidrogénkötések vízzel:
Ezért, rövid szénláncú aminok könnyen oldódik vízben. Mivel egyre több és méretét szénhidrogéncsoportok aminok vízben való oldhatósága csökken, mivel megnövekedett tér megakadályozza a hidrogén kötések. Aromás aminok vízben gyakorlatilag rastvoryayutsya.Anilin (fenil-amin) S6H5NH2 - egy kulcsot aromás aminok: anilint színtelen, olajos folyadék, jellegzetes szagú (forráspont 184 ° C-on, olvadáspont: - 6 ° C ....). A levegő gyorsan oxidálódik és pirosas-barna színű. Mérgező. Az égési reakció (oxidáció teljes) amin például metil-: 4SH3NH2 + 9O2 → 4CO2 + 10H2O + 2n2
Ezt a vegyületet tartalmazó a molekulában egyidejűleg c. -NN2i OH. Az első tagja homológ sor
2-amino-etanol-1, monoetanol-amin, kolamin
Kolamin része a komplex lipidek. Származtatott kolamina - diphenhydramin - gyenge az anti-allergiás és altató hatása.
Kolamin a t. -NH2 tulajdonságait mutassa aminok és alkoholok.
P-CIÓ bekövetkező -OH csoporttal, c: a Me, RS15, HC1, R-C1, R-COC1; p-CIÓ oxidáció és a kiszáradás.
1. Kölcsönhatás aktív fémeket.
2. Kölcsönhatás RCl5 és HCI (SN reakció)
3. Kölcsönhatás halogénezett alkánok:
4. Kölcsönhatás savanhidridek:
1. Kölcsönhatás erős savak képződéséhez vezet a stabil sókat.
2. Kölcsönhatás vízzel.
3. A reakciót savanhidridek.
4. Az alkilezési reakció kolamin metilezett származék-típusú chetvrtichnogo ammónium - Kolin - ammónium trimetiloksietilgidroksid:
21. Karbonsavak és származékaik. Általános jellemzők.
Karbonsavak olyan vegyületek, amelyeknek karboxilcsoportot
Minősítést. Szerint a karboxilcsoportok száma a karbonsav oszlik monokarbonsavak vagy egyértékű (egy csoport -COOH), dikarbonsav vagy kétértékű (két -COOH csoporttal), stb Attól függően, hogy a szerkezet a szénhidrogén-széklet, amely össze van kötve egy karboxilcsoporttal, egy karbonsav alifás (például ecetsav vagy akril), aliciklusos (például ciklohexán) vagy aromás (benzoesav, ftálsav). Az alábbi táblázat néhány képviselői a karbonsavak. Nómenklatúra. Az alapja a karbonsavak nevek nevei a megfelelő szénhidrogének. A jelenléte karboxil végcsoportok tükröződik -ovaya savat. Alsó karbonsavak gyakran közhasználatban: hangyasav, ecetsav, vajsav és dr.Uglevodorodnuyu lánc számozzuk kezdve a karboxil-csoport szénatomján, például:
CH3-CH = CH-COOH butén-2-sav
Gyakran tekintik, mint egy karboxil-csoport szubsztituens a szénhidrogén-molekula. Így a használat a cím kifejezést „karbonsav” és a számozás a szénatomok a lánc szénatomján karboxilcsoport nem tartalmazza: CH3 (CH2) 7 CH = CH (CH 2) 7 COOH heptadecil-8-karbonsav (olajsav)
Nevei dikarbonsavak előállított a neve a megfelelő szénhidrogén egy utótag „diovaya”, és a „sav”. Például, etándisav (oxálsav) sav (HOOC-COOH).
Ha figyelembe vesszük a karboxilcsoport mint szubsztituens, a nevét egy kétbázisú sav előállított szénhidrogéncsoport neveket azzal a kiegészítéssel, a kifejezés „dikarbonsav”. Például, maionsavat (HOOC-CH 2-COOH) nevezzük metandikarbonovoy savat.
Az izomerek. A karbonsavak, a következő típusú izoméria:
1. izoméria szénlánc. Úgy kezdődik -butánsav (S3N7SOON), amely létezik két izomer:
2Izomeriya helyzetben a többszörös kötést, mint például:
CH2 = CH-CH2-COOH, CH 3-CH = CH-COOH
Butén-sav-3-butén-2-sav
(Vinil-ecetsav) (krotonsav)
Cisz-transz izomériát, például:
cisz -but-2-oe transz-butén-2-oe
sav sav
4. Interclass izoméria például vajsav (CH3-CH 2-CH 2-COOH) izomer -propánsav-metil-észter (CH3-CH 2-CO-O-CH 3), és ecetsav-etil-észter (CH3-CO-O-CH 2-CH 3) .
5. heterofunkcionális savak van izoméria, Nye kapcsolódó helyzetben a funkciós csoportok, például, három izomer klórvajsavanhidrid sav:
CH3-CH2-CHCl-COOH CH3-CHCl-CH2-COOH
2-hlorbutanovaya-3-hlorbutanovaya savat
22. Fizikai és kémiai tulajdonságai karbonsavak.
Fizikai tulajdonságok. Telített alifás savak monokar-síkos alkotnak homológ sor, amelyet az jellemez-sére a következő általános képlettel CnH2n + 1 COOH. Az alsó tagja a sorozat normál körülmények olyan folyadékok razziák hozamú jellegzetes, átható szag. Például, etanolos (ecetsav) sav van egy karakterisztikus „ecet” szag. Vízhiány-értékű ecetsav szobahőmérsékleten folyékony; 17 ° C-on, le van fagyasztva, egyre jeges anyag, amelyet már az úgynevezett „jég” ecetsav savanyú-ta. Átlagos tagjai ennek a homológ sor - viszkózus, „olajos” folyékony; kiindulva C10 -, korlátlanul elegyedik vízzel veschestva.Kisloty szilárd 1-3 szénatomot tartalmazó.
Kémiai tulajdonságok. A karbonsav - több erős savakat, mint alkoholok, mint hidrogén Karbokam-erős sáv magas mobilitása miatt a befolyása a CO-csoport. A vizes oldat, karbonsavak disszociálnak: RCOOH RCOO- + H +
Mindazonáltal, mivel a kovalens jellege molekulák szén-O sav disszociációs egyensúlya a fent említett meglehetősen erősen balra tolódik. Így, karbonsav - rendszerint gyenge savak.
2. sóinak kialakítása. Karbonsavak összes tulajdonságait hagyományos savak. Ezek reagálnak az aktív fém-Lamy, bázikus oxidok, sók a gyenge bázisok, és Kitty Lot:
Karbonsav-- gyenge, azonban az erős ásványi savak kiszorítják őket a megfelelő só: CH3 COONa + HCI → CH 3 COOH + NaCl.
Karbonsavak sóit vizes oldatban hidrolizált: CH3 COOK + H 2 O CH3COOH + KOH. 4. Egy sor karbonsavak tulajdonságok jelenléte által okozott szén-hidrogén-csoportot jelent. Így, az intézkedés alapján a sav a halogén jelenlétében vörös foszfor, halogénatom keletkező savakat, valamint a halogénatom hidrogénatomra cseréljük le co-sednja hogy a karboxil-csoport a szénatom (a-atom):
Hangyasav HCOOH számos funkciók, mint az összetételében van egy aldehid csoport:
Hangyasav - erős redukálószer és könnyen-oxidok kívánnak létrehozni CO2. Ez adja meg a reakció az „ezüst tükör”:
Ezen túlmenően, a hangyasav oxidáljuk klór: Cl2 + HCOOH → CO 2 + 2 HCI.
Az oxigén atmoszférában karbonsav oxidált CO2 és H2 O: CH3COOH + 2O2 → 2CO2 + 2H2 O.
6. Reakciók dekarboksshirovaniya. Telített szubsztituálatlan monokarbonsavat, mert a nagy szilárdság a C-C hevítéssel dekarboxilezünk nehezen. Erre a q.s. Dimo fúziós-alkálifémsójának egy karbonsav alkálifém:
23. aminosavak. Általános jellemzők: szerkezete, nómenklatúra, izoméria.
Aminosavak egy olyan vegyületre vonatkozik, amely tartalmazza mind amin és karboxilcsoportok. A legegyszerűbb aminosavak triviális neveket. Általában azonban, ezek az úgynevezett, mint a megfelelő savak és helyette jelölő relatív helyzete aminosav betűk # 945;, # 946;, # 947;, # 948; .. És így tovább is használja a nevét az IUPAC nómenklatúra szerint
glicin, glicin, glicin, aminoetanovaya
lizin, # 945; # 948; -diaminokapronovaya, 2,6-diaminogeksanovaya
Aminosavak tartalmazhatnak egy vagy több savas csoportot, és különböznek bázicitása. A molekulában az aminosav is tartalmazhat egy pár aminocsoportokat. Attól függően, hogy a kölcsönös helyzetének az amino- és a karboxil-csoportok az aminosavak vannak osztva # 945; -, # 946; -, # 947; -, # 948; -, # 949; - és így tovább ..
2. Attól függően, hogy hány savas funkciós csoportot különböztetünk, semleges és lúgos.
3. A természet a szénhidrogéncsoport megkülönböztetni alifás (zsíros), aromás és heterociklusos, kéntartalmú aminosavak. A fenti aminosavak lásd zsírsav sorozat. Az aromás aminosavak arra szolgálhatnak például a para-amino-benzoesav:
Példa a heterociklusos aminosavak arra szolgálhatnak, mint triptofán - lényeges # 945; - aminosav
NOMENKLATURa.Po szisztematikus nómenklatúra, aminosav-nevek származnak a nevét a megfelelő savak hozzáadásával előtagok amino- és jelzi azt a helyet, az amino-csoportot, hogy a karboxil-csoport. A számozás a szénlánc egy szénatom a karboxilcsoport.
IZOMERIYA1. Izoméria a szénváz
2. A helyzeti izomerek funkciós csoportok
3. Az optikai izomerek
# 945; aminosavak, kivéve a glicint NH2-CH2-COOH.