Folyékony fázis egyensúlyi keverékei
Osztályozása kétkomponensű keverékek. Ha hő miatt, Vågå mozgását molekulák a folyadékot a gőztér az időegység alatt áthalad a azonos számú molekulát, mint mozgott vissza a gőz a folyadék közötti a folyékony keveréket, tokba zárt edényben, és a gőz fölött a mobil fázis jön létre. " egyensúlyt.
A termikus mozgása molekulák az oka a gáz tágulását, amely érzékeli, mint egy „termikus nyomás”. Ez a nagyobb, minél magasabb a hőmérséklet, annál több molekula egységnyi térfogatra. Az ideális gázok egyenesen arányos a termikus nyomás. abszolút hőmérséklet és fordítottan arányos a fajlagos térfogat. Thermal folyadéknyomás, amelynek, mint ismeretes, sokkal kisebb fajlagos térfogatú, mint a gáz egy bizonyos hőmérséklet eléri több ezer atmoszféra, t. E. lényegesen nagyobb, mint a gáz. Ideális gázok, és a ^ praktikus és párban, a termikus nyomás-kiegyenlített felülmúlja a külső nyomást; folyadékokban ez bőségesen ellensúlyozza irányul az ellenkező irányba, hogy a e o g H és - onnym nyomást, amely által okozott belső B-Lamy vonzás molekulák. A felesleges hő nyomását összetartó - i Nym - egy pár nyomást.
gáznemű vagy folyékony keveréket a parciális nyomások is figyelembe kell venni, mint a termikus nyomás az egyes komponensek, csökken az összeg a kohéziós erő. A keverékek ideális gázok és gőzök elhanyagolható, amelyben a kohéziós erők, így a részleges-Leniye egyes komponensek egyenlő a termikus nyomást, és ennek következtében, de, adott hőmérsékleten arányos a molekulák száma rendre stvuyuschego-komponens egységnyi térfogatra.
Mivel a részleges nyomása a komponensek a keverék a folyadékok elsősorban határozza meg kohéziós erők, szükség van az első - csak úgy a kölcsönhatása az egyes molekulák.
Tegyük fel, hogy az erő, amellyel a folyékony rajzolt két szomszédos mo-a molekula egyik komponense egy, az erő a kölcsönös vonzás két molekula között a második komponens A22 és végül A12-molekuláris vonzó erő a két eltérő komponenseket.
Ha az erők au, A22 és A12 egyenlő, akkor a folyadék egymásban kölcsönösen oldódnak egymásban minden tekintetben, és ezek keverékei, és d e nevezzük l. n s. és m. Ra c t o r a m i.
A teljes erő, amely minden olyan molekulát, megmarad a keverékben nem függ ebben az esetben a keverék összetétele, mint a közömbös, hogy okra felesége molekula nagyszámú molekulák az első vagy a második komponens. A parciális nyomása a komponens függ csak a számát a molekulák az időegység alatt eléri a folyadék felszínén, a minimális sebesség szükséges kohéziós erők leküzdése. Ezen a hőmérsékleten a nyomás a megfelelő összetevő helyezése-olvasztott arányában annak tartalmát a folyadék.
Az ideális megoldás közötti egyensúly folyadék és gőz száj ütközés iránya Raoult törvénye.
Ha a vonzóerő a molekulák két különböző komponensek kevesebb erőt fel A1x és a22, a molekula marad oldatban gyengébb, mint abban az esetben, ha ezek körül a molekulák csak az egyik összetevője. Ezért könnyebb molekulák bemegy a gőztér, és hogy a parciális nyomása az oldat felett, mint egy ideális megoldás (keveréke pozitív eltérés Raoult törvénye).
Vannak még olyan keverék, amelyben az erő a12 jelentősen nagyobb teljesítményt, és a22. Ezután molekulák erősen megőrzött komponenseket a nettó perces, és ezért a parciális nyomása kisebb, mint ideális szol-PAX (keveréket egy negatív eltérés Raoult törvénye).
Ha az erő a A12 nagyon kicsi összehasonlítva A1x és A22, ugyanazt a molekulák hajlamosak kapcsolódni, és a különböző molekulák vannak elválasztva egymástól. Ebben az esetben, rétegzett keverék és ezért áll a kölcsönösen oldhatatlan folyadékok.
Szintén ideális oldatok és keverékek kölcsönösen oldhatatlan folyadékok elegyei folyadékok részleges oldhatóságát egymással.
Így, az összes kétkomponensű folyékony keveréket, mértékétől függően a-sti kölcsönös oldhatósága azok összetevői, lehet három csoportba sorolhatók:
folyékony, kölcsönösen oldódik bármilyen kapcsolatot;
folyékony részlegesen oldódik egymásban;
folyadék, kölcsönösen oldhatatlan,.
Folyékony, kölcsönösen oldódik bármilyen kapcsolatot. Amikor a folyékony keveréket két komponensből áll, teljes mértékben oldódik egymásban, a rugalmassága az egyes komponensek gőzök csökken, és a teljes nyomás gőz keveréket, a forráspont és a gőz koncentrációja nem állandó, változó attól függően, változások a CO-Stava folyadék keverék.
Folyékony, kölcsönösen oldódnak semmilyen kapcsolat, vannak három csoportra oszthatók:
1. keverékei folyadékok, amelyek oldhatók bármilyen kapcsolat, nincs állandó ütemben-SÁGI forraljuk. A felszabadított elpárologtatása során a folyadék-gőz stey annak összetétele eltér az összetétele a folyékony keverék, a könnyen illó komponens a gőz a folyadék feletti mindig magasabb, mint a folyadék-sti. A forráspontja ezeknek a keverékeknek, összetételüktől függően változik tartományban a forráspontja a tiszta komponens másik komponenshez forráspontja közötti hőmérsékleten.
A keveréket két folyadék egymásban kölcsönösen oldódnak semmilyen kapcsolat, ez egy olyan rendszer, amely két fázisból, és a két komponenst, és ezért a szabály fázisú rendszer, amelynek két finom ste szabadságot.
Azonban gyakorlati okokból, úgy egyetlen változó állandó sósav és épít fázisdiagramját a sík koordináta rendszerben. Így lehetséges a következő fázisdiagramok: nyomás-hőmérséklet (a készítmény állandó), a nyomás-összetétel (állandó hőmérsékletű), a hőmérséklet-készítmény (állandó nyomás).
Példaként tekintsük a fázisdiagramok két - komponens benzol és toluol.
Ez a keverék ideális, és ezért a parciális nyomása komponenseinek Raoult-törvény (állandó hőmérséklet): illékony komponens (benzol)
A nemillékony komponens (toluol)
Ahol Rd-rugalmassága a tiszta komponens Egy pár; PB-gőznyomása tiszta B komponens; Ha a molekuláris aránya az A komponens a folyékony; 1 - ha a molekuláris frakció a B komponens a folyadékban.
Értékek ismeretében pA és PBJ találni obshee gőz elegy P nyomás összegeként parciális nyomása a komponensek
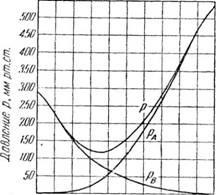
A fenti három egyenletet látható, hogy állandó tempera-kerek, parciális nyomások a komponensek és a teljes gőznyomása a keverék a lineáris összefüggés a molekuláris aránya xA könnyen illó komponensének a folyadékban. Ábra. 376 / függően előre fel grafikusan, közvetlen ügynökök és DA jelentenek változást a parciális nyomások a komponensek, és a vonal az AB-változás obshego nyomást.
Annak meghatározására, a hőmérséklet a forró elegyében adott összetételű, kialakítani a fenti módszerrel tartományban izotermák AB, A'B”, A»B«expressz-nek a teljes gőznyomás különböző hőmérsékleteken (/, ∞, i„). A vonalak a parciális nyomások PA és PB kapott vegyületet pontok egy, a 'a "hogy a D pont és a B pont, B', B" ponttól O.
További hajtjuk vízszintes vonal MN, illetve külső nyomás hozzá. Visszaállítása egy megfelelő pontban adott CO-stavuhA * függőleges vonalat keresztezi vonal MN, amelyek R-pont a izoterma T. Ezen a hőmérsékleten a T összesen gőznyomását az elegyet egyenlő a külső nyomással, és a T hőmérséklet az a forráspontja a keverék hőmérséklete sostavahA-
Ha ily módon meghatározhatja keverékei forrásban lévő idő-Nogo készítmény (ugyanazon a nyomáson) ábrázoljuk az abszcisszán készítmények és a megfelelő forráspont hőmérséklete ordináta tengelyen ray a forráspont görbével. 376, II, a keverék szol-ben toluol. A felső görbe a ábrán a CO-egyensúlyi válnak gőz forráspontján a keverék.
Amikor a keverék xx mol illékony frakciót (benzol) és a TEM-mérséklet TX gyakorlatilag csak egy folyadékfázisú benzol és toluol. Növekvő hőmérséklettel a keverék úgy tűnik, hogy a t2 x2 gőz fázisú készítmény. Mivel a nyomás állandó, akkor jelenlétében két fázis csak egy szabadságfokot, és így megváltozik a változás-mérséklet és összetétele a fázisokat.
A további növekedése a hőmérséklet a folyékony fázis mennyisége csökkenni fog, és a gőz növekszik, és a hőmérsékletet, amikor a készítményt a gőz egyenlő lesz az összetétele az eredeti keverék,
Ugyanezen a grafikonon ábrázolható egymást követő kondenzációs folyamat kezdve sostavah2 gőzfázisú, és számos későbbi, egymást követő kondenzációs és párolgási folyamatok folyadékot kapjon egyik állandó-tiszta nem illó komponenst.
A relatív pozíciója a görbék a fázisdiagramok által adott első törvény DP Konovalov: A dúsított gőz komponense, hozzátéve, hogy a folyadék, amely növeli a gőznyomása, vagy csökkenti annak forráspontja. Ez a törvény alkalmazható bármely zsidó-kim keverékei. A benzol hozzáadásával a benzol-toluol elegy csökkenti a forráspontja, és ezért a benzol koncentrációja a pár magasabb lesz, mint a folyadék. Ábra. 376 azt mutatja, hogy egy ilyen helyen zheniyu-görbék, amelyek a görbe összetétele a gőz a folyadék feletti készítmény mindig görbe.
Átlós megfelelő ekvivalens mennyiségű illékony összetevőt-NENT gőz és a folyékony = y.
egyensúlyi görbéje megoldásokat engedelmeskedik Raoult törvénye, ez lehet kialakítani (lásd. o. 457) az alábbi egyenlet
UA = _____________ (3-165)
Ahol A a relatív volatilitását. Mivel a számot, és
Minél több a görbe eltér az átlós, annál nagyobb a különbség a redőny gőz és a folyékony, és annál könnyebb elválasztani a keveréket összetevői. A dia-gram-x fázis szempontjából gőz és a folyadék egyesült egyetlen ponton mindig feküdt a egyensúlyi görbéje.
az egyensúlyi görbe és az átlós oltalmi körét korlátozni kölcsönös létezését két fázis. Fent a egyensúlyi görbéje a régió pár, az alsó tartomány a folyadék.
Tipikus példák az ilyen keverékek vizes oldatai ásványi savak, mint például a vizes oldatok a salétromsav és hidrogén-klorid.
Fázisdiagramok a keveréket salétromsav-víz ábrán mutatjuk be. 377.
Tiszta víz forrni kezd, 100 °, világos-salétromsavat 86 °, -races létrehozza a HN03 vízben tartalma 68,5 tömeg% HN03. forr állandó hőmérsékleten van 121,9 °.
A T-X-diagram (ábra. 377, II) görbéje forráspontja hőmérsékleten ezt az elegyet a készítmény maximális forráspontú (M pont). Összhangban a törvény Konovalov felső görbe a Chamber-pár készítmény, az alsó-folyékony készítmény különböző tempera-fordulóban forralás és állandó nyomás.
Ábra. 377, III látható -x-chart keverékét nitrogén Kitty csomó-víz. Az M pont, ahol a görbe metszi az átlós, megfelelő
0 10 20 30 40 50 60 70 80 00 100
/ A 20 30 40 50 60 70 80SO77777Soderzhal / іє lellol / e / PU / ő / salétromsav és a P7 és evés /)% tlII
Ábra. 377. diagramok p-x (1), I-x (11) x-uy (111) számára keveréket maxi-mal forráspontú (nitrogén-értékű sav-víz).
Létezik egy azonos készítmény folyadék és gőz; ez az úgynevezett egy jellemző pont. A jelenléte az ilyen pont-ki azt jelzi, hogy a keverék nem lehet elválasztani az on-stavlyayuschie nettó com-nents.
3. keverékei folyadék-stey kölcsönösen versenyek - SO oldódik bármelyik-visel, amelynek összetétele egy bizonyos konstans forráspontja a forráspont alatt a tiszta komponensek a keveréket alkotó (CME-B, amelynek legkisebb forráspont hőmérsékletén). A desztillációs folyadékok állandó forráspontú összetétele a gőz azonos lesz a folyékony készítményben, és: így ők is lehetetlen elválasztani a tiszta komponenseket.
Tipikus példák az ilyen keverékek keverékei vizes etanolban, és etil-alkoholt benzollal.
Az azonos összetételű folyadék és gőz.
Keverékek, amelyeknek maximális vagy minimális Ki ének hőmérséklet desztillációs nerazdelnokipyaschuyu lehet osztani a keveréket az eltávolító készítmény x0 és fölös (szemben a készítmény elválaszthatatlanul - forró keverék) komponensek a maradékot; megkapja mind komponensek tiszta formában desztillációjával ilyen keverékek nem lehetséges.
Példaként tekintsük a fázisdiagram ábrán. 377, II. A folyékony készítmény a kezdeti X> x0 hőmérsékleten forr TX és gőz összetétele ad át dúsított több illékony komponens. Során regonki NE dúsított folyadék kevésbé illékony komponens, és X pontban balra mozdul. Az eredmény egy tiszta les tuchy összetevője a desztillátum keverék és nerazdelnokipyaschuyu összetétele x0 a maradékot, de további felosztása a keverék nem lehetséges, mivel ez forr megváltoztatása nélkül a készítmény
Ha a kiindulási elegy összetétele x '<Сх0, то она закипает при температуре tx и дает пар состава у', обогащенный менее летучим компо-нентом. В процессе перегонки точка х' перемещается вправо, и перегонка приводит к разделению смеси на менее летучий компонент в дистилляте и нераздельнокипящую смесь в остатке.
Folyékony részlegesen oldódik egymásban. Tanulmányok CME-e részlegesen oldódik egymásban folyadékokat első visszacsapó Dena Abashevo Alekseevym és [4]. Alekseev megmutatta kidolgozásának lehetőségét, parabolikus jellemző betétek Az oldhatósági görbék. Mindegyik görbe áll a két ág, konvergáló össze olyan hőmérsékleten „maximális oldhatóságot. Eddig a pontig a két folyadék keveredve ad egy ismert koncentrációtartományban két fázist ábrázolás, az összegeket a két megoldás különböző összetételű (folyékony oldat) a folyékony B, és az oldatot a folyadék a folyékony a). általános pontot, mindkét megoldás összetétele azonos.
A hőmérséklet ennek megfelelő maximális pontot nevezzük a kritikus oldhatósági hőmérséklet. Magasabb hőmérsékleten, A két folyadékot összekeverjük, t. E. kölcsönösen oldódnak semmilyen módon.
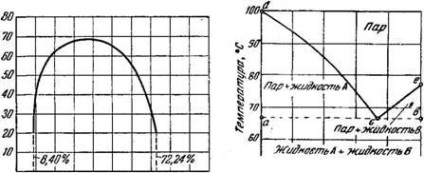
A klasszikus példa a részlegesen oldható folyadékok fenolt és vizet tartalmaz. 20 ° víz oldja 8,4% fenolt, és 50 ° rimost szol-fenolt vízben növeljük 12,08%. Fenol viszont feloldja a vízben 20 ° mennyiségben 27,76%, és 50 ° -37,17%.
Ha a kölcsönös oldhatóságát fenolt és vizet, hogy ábrázolja dia-gramm (ábra. 379), úgy tűnik, hogy az oldhatóság görbék képviselt jelenleg az egyik-görbe áthalad a maximuma megfelelő pontra-vezető készítmény, 35,99% fenol £ = 68,8 °.
Amikor a rendszer csak egy folyadékot és egy gőzfázisú, ^ vonatkozik minden, ami elhangzott a folyadékok, teljesen elosztott
oldható egymáshoz. Amikor a két folyékony fázis és egy gőz-Leniye megakadályozza gőz keveréket mindaddig állandó marad, amíg vannak két rétegben, azaz. E., Egy ilyen rendszer egyfajta keveréke kölcsönösen oldhatatlan folyadékok.
Az ilyen esetek figyelhetők meg és korlátozott oldhatósága a két folyadék, amikor teljesen elegyednek bekövetkezik nem magasabb, és alacsonyabb hőmérsékleten. Egy példa lenne a víz és trietil-amin, amelynek van egy minimális kritikus oldódási hőmérséklete egyenlő 20 °.
Ábra. 380. DiagrammaT azon a Nesmith - Shiva folyadékot.
Bizonyos keverékek két folyadék (például nikotin, és a víz) a maximális és minimális kritikus hőmérséklet szol-rénium, és ezért azok kölcsönös oldhatósági görbéje egy zárt vonal.
Folyadékok kölcsönösen oldhatatlan. Amikor összekeverjük a két kölcsönösen oldhatatlan folyadékok, amelyek mindegyike megtartja teljes tulajdonságait. Ezt a keveréket könnyen szétválasztható alkatrészek mechanikai eszközökkel, végzett ülepítéssel. A rendszer két részből áll, és három fázis, és ezért egyetlen foka-a Baud-okban adjuk. Ez - azt jelzi, hogy az egyes érzékelt hőmérséklet illeszkedik tökéletesen keverjük össze egy bizonyos nyomást, és az egyes komponenseket úgy fog viselkedni, ha ez az egyik tiszta formában.
Más szavakkal, egy keveréke kölcsönösen oldhatatlan folyadékok, a parciális nyomás az egyes komponensek független annak tartalmát a mix, és egyenlő a nyomás a tiszta komponens gőz ugyanazon a hőmérsékleten.
ab vízszintes a diagramon korlátozza a létezését régió a folyadék keverék A és B, valamint a C pont felel meg az állam a forró elegyében, és az elegyet forrásig hőmérséklete alacsonyabb a forráspontja az egyes komponensek. Ez a tulajdonság a szakterületen
desztillációs magas forráspontú folyadék, gőz. A közötti arány a teljes tömeg és a VYM mennyiségű komponenseket a gőzt képlet szerint
Teljesen oldhatatlan folyadékok nem létezik; való oldhatósági foka nagyban függ a hőmérséklettől. Azokban az esetekben, ahol a nem-elhanyagolható oldhatósága elhanyagolt feltételezve, egymással lényegében oldhatatlan folyadék, amely lehetővé teszi, hogy használja a fenti (3-166).
A legegyszerűbb program elszívás dei Corollárium periodikus kivonása szilárd ábrán látható. 401. előállítása közelében-zhaschaya extraháljuk, betöltve extraktor 1, ahol a megtöltött és egyidejűleg egy bizonyos mennyiségű tiszta oldószerrel. Through ...
Molekuláris diffúzió. azok összetételét állandó marad fázisegyensúly. Diffúziós folyamatok folytassa csak a megsértése a fázis egyensúlyi, a compo-NENT között megosztjuk átmenetek az egyik fázisból a másikba. A ...