Egyenletek állapotban földgáz - studopediya
A tudomány anyag alapul jelenlegi ismeretek atomok - a legkisebb részecskék az elemek és molekulák - apró részecskék kémiai vegyületek. Az atomok mérete körülbelül 10
8 cm-es (egy angström). Nagy molekulák tartalmazó ezer atomok van egy mérete körülbelül 10
. 6 cm Karakter mozgást az atomok és molekulák, valamint azok kölcsönhatását határozzuk bármely halmazállapotban olyan anyag - szilárd, folyékony vagy gáz halmazállapotú.
A molekulák alávetni transzlációs, rotációs és vibrációs mozgást. Ha az anyag a gáz vagy folyékony állapotban, lehet, hogy mind a három mozgását. Ha az anyag megszilárdul, a túlsúlyban lévő forma a molekulák és atomok válnak ingadozások.
A tanulmány a halmazállapot inkább megtalálják a kapcsolat a nyomást. ahol az anyag, a sűrűség és a hőmérséklet. Ha jelöli a p nyomás. sűrűség # 961;, és annak inverz értékét - fajlagos térfogata az anyag V, és a T hőmérséklet, az állam az anyag fogja jellemezni p, V és T vagy, mint a termodinamika, -sootnosheniem. Legegyszerűbben ezt az arányt úgy tűnik, hogy a halmazállapot, amelyben a molekulák végre transzlációs mozgása közötti ütközések egymással, és a molekulák közötti erők nem jelennek meg jól láthatóan. Ez az állapot anyag, amelyet kellően hígított gázok. Anyag ebben az állapotot nevezik ideális gáz. Egy ideális gáz szerint Clapeyron egyenlet - Mengyelejev
ahol - a nyomás Pa; - gáztérfogat m 3 - a tömege gáz, kg; - gázállandó J / (kg • K); - abszolút hőmérséklet, K.
A gázállandó számszerűen egyenlő a tágulási 1 kg ideális gáz izobár a hőmérséklet növelésével a gáz 1 K
A magas gázkompresszió paraméterek többé nem lehet leírni az állapotegyenlet az ideális gáz. Van der Waals került be a állapotegyenlet az ideális gáz (2,27), korrekció: érték b. figyelembe véve a hangerőt a molekulák maguk, és az érték egy / v 2. figyelembe veszi a kölcsönhatás a molekulák. Az eredményt a következő egyenlettel az állami „valódi gáz” (a van der Waals-erők) a következő formában:
A nehézség egyenlet (2.28) gyakorlati célokra is, hogy a valóságban gazoneftepromyslovom általában gázok keveréke, melyek egyenlete van der Waals esetben nehezen.
Jó egyezést a kísérleti adatokat, gáz, amelynek sűrűsége kisebb, mint kétharmada a gáz sűrűsége kritikus körülmények között, kapjuk a következő egyenlet Beattie-Bridgman
ahol a, b, c, Ao és Bo - állandók adatkomponensek földgáz, amelyek kiszámítása a vizsgálati adatok alapján.
Szuperkompresszibilitási tényező. A nagyszámú komponens a számításokhoz fenti képlet lesz időigényes. Ezért számítani az állam a reális gázok általában általánosított formában gáztörvény Clapeyron egyenlet, amelyben a korrekciós (szuperkompresszibilitási faktor), figyelembe véve az eltérés a tényleges gáz kompressziós és expanziós törvények ideális gázok.
ahol z - szuperkompresszibilitási faktor; - gáz tömege kg; p - nyomás Pa-ban; V a gáz térfogata, m 3; R - gázállandó J / (kg * fok); T - az abszolút hőmérséklet K.
Character megváltoztatja szuperkompresszibilitási faktor Z, ami azt jelzi, az arány a valós gáz térfogata a térfogatának egy ideális át azonos körülmények között, a hőmérséklet-változások és a nyomás állítható be, eltérések figyelembevételével a valós gázok ideális. Az utóbbi molekulák foglalnak jelentéktelen mennyiségű (összehasonlítva a gáz mennyisége), és nincs vonzóerő egymáshoz. Molekulák azonos reális gázok bizonyos méretek, tömeg és kölcsönhatásban vannak egymással. Ezért reális gáz megközelíti az ideális alacsony nyomáson, amikor a molekulák száma egységnyi térfogat kicsi. Ezért alacsony nyomáson, a kompresszibilitási tényezőt értéke közel legyen az egység. A növekvő nyomás gázmolekulák közeledik egymáshoz, és az erők közötti vonzás molekulák elkezdenek segít a külső erők tömörítése a gázt. Következésképpen reális gázok tömöríteni kell erősebb, mint azonos körülmények között ideális sűrített gáz. Következésképpen, a nyomás növeli a kompresszibilitási tényező z kell kezdetben csökken. Amikor a szénhidrogén gáz kompressziója olyan mértékben, hogy közel van a tulajdonságok a folyadékok, az intermolekuláris távolságok csökkennek úgy, hogy azok kezdenek megnyilvánulni vzaimoottalkivayuschie erők közötti molekulák megakadályozzák a további csökkentése a gáz térfogata. Ilyen körülmények között, a szénhidrogén-gázt kell sűrített kevesebb, mint alacsony nyomáson, m. F. Z értékek újra növekedést a nyomás növelésével.
Ahogy a nyomás és a hőmérséklet megközelíti a kritikus értékek a tulajdonságait a gáz- és folyadékfázis vált azonos, a határfelület eltűnik, és sűrűsége kiegyenlítődik.
A kritikus hőmérséklet (TCR) - maximális hőmérséklet, amelyen a gáz és a folyadék továbbra is ko-egyensúlyban létezik (lásd a 2.4.).
Kritikus nyomás - gőznyomás anyag kritikus hőmérséklete (2.3 táblázat.), És a térfogatot az anyag az adatokat Ta és a PKR. értékkel, a 1 mol vagy egységnyi tömegű anyag, az úgynevezett kritikus fajlagos térfogata.
Rugalmasság telített szénhidrogén gőzök, a nyomás, amelyen a gáz kezd lecsapódik, és folyékonnyá váljanak növekszik a hőmérséklet növelésével, és a magasabb ez, annál kisebb a sűrűsége a szénhidrogén.
2.4 táblázat A kritikus nyomását és hőmérsékletét komponensek gázolaj
ahol p és T - a gáz nyomását és hőmérsékletét; rKri Tkri és - a kritikus nyomás és az abszolút hőmérséklet az i-edik komponense; = U - srednekriticheskie (pszeudokritikus) az abszolút hőmérséklet és nyomás; yi - moláris koncentrációja az i-edik komponens a gáz.
Így a PNP és TPR kifejezni abszolút nyomáson és hőmérsékleten a frakciók a megfelelő kritikus értékeket.
Különböző gázok, amelyeknek azonos csökkentett hőmérséklet és a nyomás, vannak a „megfelelő Államokban.”
Elve szerint a megfelelő kimondja termodinamikai tulajdonságait anyagok (beleértve összenyomhatósága együtthatóit különböző gázok), amelynek egyenlő
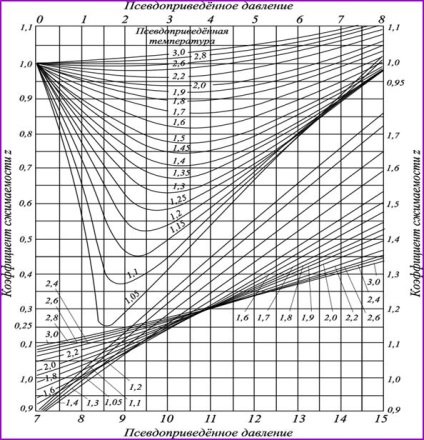
Ábra. 2.10. Együtthatók szuperkompresszibilitási szénhidrogén gázok,
Attól a szereplő adatokat paraméterek
adott hőmérsékleten és nyomáson megközelítőleg azonos, mert ebben az esetben vannak különböző gázok, mintha ugyanazon a relatív közelítés a folyékony állapotban. Ezért grafikus szuperkompresszibilitási faktor z, csökkentett koordinátáit homológ sor szénhidrogének egybeesnek kielégítő pontossággal gyakorolni. Ennek alapján a grafikonon (ábra. 2.10) lehet kiszámításához használt fajlagos térfogat és paraméterek bármely más gáz (beleértve a gázkeverékek), ha tudjuk, hogy a kritikus paramétereket (tabl.2.4).
A grafikonok (ábra. 2,10) érvényes a gáz nem tartalmaz jelentős mennyiségben nem-szénhidrogén komponenseket. A legtöbb nem-szénhidrogén komponenst jellemzően nitrogén. Ezért a gáz szuperkompresszibilitási faktort ki lehet számítani a szabály additivitás képletű
ahol - a móltörtje a nitrogén; - nitrogén szuperkompresszibilitási faktor (ábra 2.11.); - a kompresszibilitási tényező a szénhidrogén része a gáz.
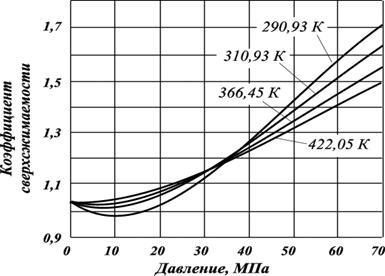
Ábra. 2.11. Attól együtthatók szuperkompresszibilitási nitrogén-nyomás és hőmérséklet
A szuperkompresszibilitási faktor Z könnyű meghatározni a V térfogata a gáz különböző körülmények között. Egyenlet szerint (2.30) a gáz mennyisége minden körülmények között (hőmérséklet és nyomás p T) egyenlő lesz
Térfogati gáz arányt alkalmazunk szempontjából által elfoglalt térfogat gáz normál körülmények között olajmező körülmények között, és fordítva, például kiszámításakor tartalékok.