A paraméterek és állapotegyenlet
A paraméterek és a állapotegyenlet.
Rövid elméleti rész
Termodinamika, általános tana az energia alapvető általános mérnöki tudomány. Mint minden tudományágban, termodinamika saját elképzelések és matematikai apparátus. Prioritás koncepció termodinamikai rendszer - valamit, ami a termodinamika munkák.
Termodinamikai rendszer (TS) - egy korlátozott területen a tér (a dolgozó szervezet - PT), figyelembe kell venni, hogy a környezet.
Paraméterek állapot - makroszkopikus változók jellemzik az állam a jármű, és attól függően, hogy annak tulajdonságait.
A paraméterek közé tartozik a a jármű állapotának:
fajlagos térfogat - v, m3 / kg;
Kelvin hőmérsékleten - T, K;
T = 273,15 + T, ° C; (1.1)
abszolút nyomás - pata, Pa;
Pata = Pati + B; (1.2)
Pata = B - RVAK (1.3)
ahol: Pata - abszolút nyomás Pati - túlnyomás B - légköri nyomás PVAK - vákuum.
Nyomás Units:
Az SI - [P] = Pa = N / m2 (N = 1 kg x 1 m / s2);
egy nem-rendszer egységek - 1 bar = 105 Pa = 750 Hgmm;
műszaki rendszer egységek - 01:00 = 1 kgf / cm2 = 0981 × 105 Pa = 735,6 mmHg = 10 mH2O
kg az az egység erő: 1 kg = 9,81 N.
kg az az egység, súlya: 1 kg = 1000 Ez egy referenciaértéket.
kg azt jelenti, hogy 1 kg erő szükséges a 9,81 N.
fizikai környezet - 1 nat. al. = 760 mm Hg = 101325 Pa.
Konverziós arány: 1 Hgmm = 133.322 Pa; 1 mm H2O = 9,81 Pa.
Normál körülmények között a jármű állapotban a következők:
nyomás 101325 Pa;
hőmérséklet 273,15 K.
Egység energia mérése:
Az SI - 1 J = 1 Nm = 1 × kg m2 / s2
A műszaki rendszer egységek - 1 cal.
A transzfer arány: 1 cal = 4.184 J.
A funkciók az állapot a következők:
belső energia - u; [U] = J / kg;
entalpia - H; H = u + Pv; [H] = J / kg;
Entropy - s; [S] = J / kg × K.
A belső energia a jármű - a teljes energia a jármű mínusz a kinetikus energia a jármű egészének és a benne rejlő energia helyzetét. Belső TC energia függ az anyag jellegétől, és annak tömegét TC állapot paramétereit. A növekvő tömeg arányosan növekszik, és a belső energia, mivel kiterjedt TC tulajdonság. Így a belső energia a jármű állapotának függvényében.
A entalpiája a jármű - az energia a jármű fokozottabb, amely a belső energia és a munka, amelyet el kell végezni annak érdekében, hogy a jármű mozgatásához V térfogata a környezetben a P nyomásnál Ahogy a belső energia, entalpia TC függvénye annak állapotát.
Minden jármű, amely egy egyensúlyi állapotban, azzal jellemezve, hogy egy állapotegyenlete formájában:
A gépjármű állapota paramétereket meg kell egyeznie az egész térfogatát. Ebben az esetben, az ő állapota teljesen határozza meg két paraméter, a harmadik pedig a funkciójukat:
P = F1 (V, T); V = F2 (P, T); T = F3 (P, V). (1.5)
Az állapotegyenlet az ideális gáz:
egy egység a jármű tömege:
Az állapotegyenlet egy igazi jármű:
ahol: R - az univerzális gázállandó; a, b - állandó mindegyik gáz.
Az egyetemes gázállandó R a következőképpen fejezhető ki:
[R] = J / (mol × K); [R # 956;] = J / (kg x K).
ahol # 956; - a moláris tömege a jármű.
Ezután az index „# 956;” kihagyja.
R = 8,314472 J / (mol × K).
Feladatok a független döntést.
Feladat № 1-1. A nyomásmérő jelzi, PM = nyomása 6 kgf / cm2 egy légköri nyomás a 752 Hgmm = RB. Mi az abszolút nyomás a RA, ha kifejezett N / m2, bar, kg / m2 kg / cm2, Hgmm, a mmN2O? Mi lesz a nyomásmérő olvasás kifejezve azonos egységben légköri nyomáson RB = 0,590 bar, ha az abszolút nyomás változatlan marad? Vegyük egyenlő a gravitációs gyorsulás g = 9807 m / s2, a víz sűrűsége # 961; B = 1 g / cm3, a higany sűrűsége # 961; RT = 13,6 g / cm3.
Feladat № 1-2. A turbina kondenzátorok tartjuk abszolút nyomáson RA1 = 0,03 kgf / cm2, PA2 = 3.807 kN / m2. Határozza meg a vákuum az egyes kondenzátor és kifejezni, mint egy százalékában RB légköri nyomás = 753 Hgmm.
Feladat № 1-3. Micromanometer (lásd. 1.1 ábra) csatlakozik a légvezeték, tele van egy sűrűségű alkohollal # 961; SD = 0,8 g / cm3. Határozzuk meg az abszolút nyomás a légvezeték, ha a hossza a folyadék oszlop a csőben micromanometer szögben ferdén # 945; = 30 °, egyenlő 180 mm, és RB = a légköri nyomás 1,02 bar. Express az abszolút nyomás bar, Hgmm, és a kg / cm 2.
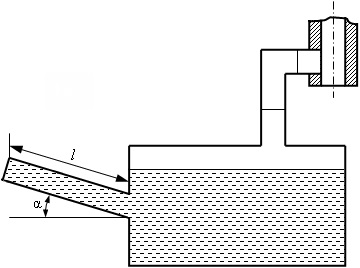
Feladat № 1-4. A nyomás a kazán RM = 0,4 bar a légköri nyomás WP1 = 725 Hgmm. Mi továbbra is túlnyomás a kazán, ha a barométer olvasás emelkedik RB2 = 785 Hgmm, és egy pár az állam ugyanaz marad a kazán?
Feladat № 1-5. A tartály tele van 4m3 térfogatú szén-dioxidot. Határozza meg a súlya a gáz, ha a túlzott nyomás PM = 0,4 bar, és a t = 80 ° C-on A légnyomás a barométer RB = 780 Hgmm.
Feladat № 1-6. Nitrogén tömege m = 3,62 kg foglal P 1 = fiz. al. T = 300 K, a V térfogat = 3,29 Nm3. Határozzuk meg a gázállandó R, lejtős Pv = RT.
Példa. Határozza meg a súlya 5 m3 hidrogén abszolút nyomás mellett PA = 6 bar és a hőmérséklet 100 ° C-on
m = (P × V × # 956;) / (R × T) = (6 × 105 × 5 × 2 × 10-3) / (8314 × 373,15) = 1,93 kg.
Feladat № 1-7. A levegő sűrűsége normál körülmények között # 961; B = 1,293 kg / m3. Határozzuk meg a levegő sűrűsége nyomáson P = 15 bar, és a hőmérséklet T = 20 ° C-on
Az első főtétele.
Rövid elméleti rész
A termodinamika első főtétele egy speciális esete egy általánosabb törvény - a törvény az energiamegmaradás. A termodinamika első főtétele létrehozza a kvantitatív összefüggés van a háromféle energia: hő, belső energia és a munka.
Hő és munka - ők két teljesen eltérő formájú energia nyilvánul meg az átmenet energia adatfolyam határt. És a hőség, és a munkafolyamat a függvények.
Work - ez a folyamat irányított energia átadása miatt az erő. Relatív, hogy a járművet a munka utal, hogy az erő a mozgó jármű határon. Hő - kaotikus folyamat energiatranszfer hatására gradiens (különbség) intenzív változók (független jármű súly) - a hőmérséklet (gradiens ebben az esetben # 916; T).
Sok készítmények első főtétele, amelyek közül az egyik: a hő, foglalta, hogy a jármű, költik a változás belső energia a jármű elkövetése munkáját. A matematikai alakjának első főtétele a következő:
Néhány más matematikai jelölés az első főtétele:
# 948; q = du + # 948; l; (2.2)
# 948; q = du + PDV = DH - VDP. (2.3)
Feladatok a független döntést.
Feladat № 2-1.1,5 liter vizet felmelegített üstbe elektromos teljesítménye 300 W és a visszafolyatási hőmérséklet. Annak meghatározására, a melegítés ideje # 964;, ha a kezdeti víz hőmérséklete a T = 293 K, és a hőcserélő közeggel hiányzik.
Feladat № 2-2. A kazán erőmű 20 órán égett 62 tonna szén, amelynek fűtőértéke 28900 kJ / kg (6907 kcal / kg). Meghatározzuk az átlagos erőmű, amikor alakítani elektromos energia 18% -a során keletkező hő a szén elégetése.
Feladat № 2-3. Hány kilogramm ólom lehet melegítjük hőmérséklet T1 = = 288 K és legfeljebb annak olvadási hőmérséklete Tm = 600 K egy csap a kalapács 20 kg alatt esik a magassága 2 m? Feltételezzük, hogy az összes energia a kalapács hővé, teljesen abszorbeálja az ólom. Fajhője ólom CP = 0,1256 kJ / (kg x K).
Feladat № 2-4. Az erőmű N = 100 MW tüzelőanyagot égetnek égéshővel QPH = 30000 kJ / kg. Hatékonyság állomás akciók # 951; t = 33,0%. Határozzuk meg az óránkénti fogyasztás üzemanyag G.
Példa. Gőz-teljesítmény N = 4200 kW rendelkezik # 951; t = = 0,33. meghatározzák az üzemanyag-fogyasztás óránként, ha a égéshő QPH = = 25000 kJ / kg.
Határozat. G = N / (# 951; t × QPH) = 4200 / (0,33 × 25000) = 1833 kg / h = 0,51 kg / s.
Feladat № 2-5. A levegő a hengerben foglal térfogatra V1 = 0,25 dm3, és a P1 nyomás = 1 bar. A levegő térfogata izotermális expanziós arány válik V2 = 1,5 dm3. Határozza meg a végső P2 nyomás és az expanziós munka.
Feladat № 2-6. Folyékony az edényben, és kommunikál a légkör PB = 1 bar, az egész # 964; = 30 perc, keverjük egy keverővel állandó sebességgel n = 75 min-1 és a nyomaték M = 12,2 kgm. Folyadék kiindulási térfogata V1 = 3,4 m3 növekszik, míg 3%. Határozza meg a munka bővítése folyékony és rotációs munka, az eredmények összehasonlítása.
Feladat № 2-7. Gőzturbina tölti 0,00110 kg gőz 1 kJ villamos. 1 kg gőz szükséges paraméterek töltött 3300 kJ. Hatékonyságának meghatározására egy gőzturbina telepítést.
Feladat № 2-8. Határozza meg a napi üzemanyag-fogyasztás egy erőmű N = 100000 kW, ha a hatásfoka 35%, és a égéshője QPH = 30000 kJ / kg. Is meghatározza a fajlagos üzemanyag-fogyasztás 1MDzh újrahasznosított energia.
Feladat № 2-9. A költségek felemeléséhez szükséges energiát 1,000 kg berendezés tetején a torony magassága 516 m, ha a villamos energia ára is zsaru 2 / (kW × h), és a hatékonysága a emelőszerkezet # 951; = 0,85?
Keveréke ideális gázok.
Rövid elméleti rész
A gázkeverék - mechanikus keverékét, az egyes gázok nem kívánjuk egymáshoz tetszőleges kémiai reakció. A gázkeverék lehet beállítani tömege, és térfogati moláris mennyiségeket:
A parciális nyomása a gáz:
Feladatok a független döntést.
Feladat № 3-1. A tartály kapacitása 125 m3 kokszolókemence-gáz, nyomás P = 5 bar, és T = 291 K. A gáz összetétele a következő térfogat: # 964; (H2O) = 0,46, # 964; (CH4) = 0,32, # 964; (CO) = 0,15 és # 964; (N2) = 0,07. Kiválasztása után néhány gáz nyomása csökkent 3 bar, a hőmérséklet 285 K gáztömeg fogyasztott.
Feladat száma 3-2. H2 gázállandó keverékét hidrogén és nitrogén N2 RSMESI = 882,54 J / (kg x K). Határozza meg a tömegarányai m (H2), hidrogén és nitrogén m (N2), ha a nyomás a keverék RSMESI = 1,08 bar.
Feladat № 3-3. A levegő áramlási amelynek az óramutató járásával megegyező áramlási gon = 300 kg / h és a TV = hőmérséklete 573 K, összekeverjük a füstgázáram GG = 400 kg / h, Tg = 873 K. A hőmérséklet a keverék és térfogatarányából gáz, ha ismeretes, hogy a Rg = 289,277 J / (kg x K). Vegye gázok és levegő nyomása azonos, és megegyezik a hőkapacitása hőkapacitása levegő gázokat.
Példa. A levegő durván a következő összetételű tömeg m (O2) = 23,2%, és m (N2) = 76,8%. Határozza meg a ömlesztett kiszerelésű készítmény a levegő, a látszólagos molekulatömege a parciális nyomása oxigén és nitrogén, ahol a levegő nyomása a barométer RB = 760 Hgmm.
Térfogati összetétele a levegő:
# 964; (N2) = 1 - # 964; (O2) = 1-0,21 = 0,79.
A látszólagos móltömeg:
Gázállandó keverék:
A parciális nyomás a gázok:
P (O2) = # 964; (O2) × PB = 0,21 × 760 = 159,6 Hgmm.
P (N2) = PB - P (O2) = 760-159,6 = 600,4 Hgmm.
Feladat száma 3-4. A három gázáramok összekeverjük (lásd. 3.1 ábra). Az első folyam egy oxigénsugár áramlási sebességgel G = 115 kg / h, és a hőmérséklet T = 573 K, a második - áramlását a szén-monoxid áramlási sebességgel G = 200 kg / h, és T = 473 K harmadik csatorna áramló levegő hőmérséklete TV = 673 K.
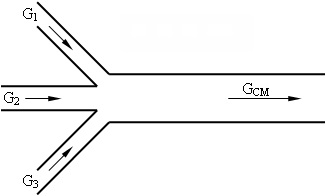
Ennek eredményeként a keverés ezen adatfolyamok, egy keveréket, melynek hőmérséklete 548 K. SCI = Határozzuk óra levegőfogyasztás, ha ismert, hogy a nyomás az összes három gáz azonos.
Feladat száma 3-5. A keveréket, amely egy oxigénatomot és két kilomole kilomole nitrogén hőmérsékleten T1 = 303 K, a nyomás P1 = 1 bar-ra hűtjük, állandó térfogaton hőmérsékletre T2 = 283 K. A változás a belső energia a keverék.
Feladat № 3-6.0,3 m3 levegőt összekeverünk 0,5 kg szén-dioxid. Mindkét gázt voltak keverni paraméterek P = 6 bar és T = 318 K. A parciális szén-dioxid nyomás összekeverés után.
Feladat № 3-7. Az ömlesztett összetétele a fűtőgáz a következő: # 964; (CO) = 10%; # 964; (N2) = 45%; # 964; (CH4) = 35%; # 964; (C2H4) = 4%; # 964; (H2) = 3% # 964; (CO2) = 3%. Ahhoz, hogy meghatározzuk a látszólagos molekulasúlya, sűrűség, fajlagos térfogata normál körülmények között, a gáz állandó R és a parciális nyomása a metán százalékban, és a tömeg frakció egyes komponensek.
Feladat № 3-8. A gázkeverék áll a 10 kg nitrogén, argon, 13 kg-os és 27 kg-os szén-dioxid. Határozza meg a moláris összetétele a keverék fajlagos térfogata normál körülmények között, a látszólagos molekulatömege a keverék és a gázállandó, említett egy köbméter normális.
Feladat № 3-9. A füstgázokat tömeg összetétele: m (CO2) = 16,1%, m (O2) = 7,5%, és m (N2) = 76,4%. Számítsuk entalpia hSMESI e gázok, említett egy kilogramm a keverék hőmérséklete 1073K mérve 273 K.