rácsok
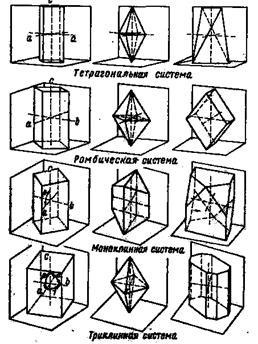
Zonke (1879 ᴦ.), Cermak, Schoenflies, Fedorov (1891 ᴦ.) És mások kimutatták, geometriailag, hogy a teljes e ?? kristályos alakban jelen lehet eredményeként megosztjuk ?? eniya pont (vesche kormányzati legkisebb részecskék) a térben szimmetria törvény ; Kapok-konfiguráció schiesya hívják kristályrétegeiben.
Elosztott szimmetria szerint elemei a pont a tér-stve, kaptak 230 kombinációk, 230 kristályrétegeiben amelyek megfelelnek teljesen ?? enni természetben előforduló kristály-alakú.
Későbbi kutatások kristályok felhasználásával készült Kiadó ray gén német tudós Laue (1912 ᴦ.) Megerősítette ezeket a feltevéseket-CIÓ és következtetések tehetők közvetve. Voltunk lucheny közvetlen bizonyíték megléte atomok, ionok, és SPO-sobov helyüket a térben.

6. ábra. Sematikus ábrázolása az OS ?? s kristályok és arcok
A kristályrács találták osztani a következő tartalmazó csoportok: atomic, ionos, molekuláris és fém.
Atomrácshibák. Minden egyes csomópont az atomi rács által elfoglalt egy semleges atom. Egy példa a kristályosodási Env argon aprításra a 7. ábrán látható.
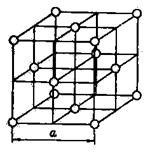
Ábra. 7. A kristályrács argon
Ionrácsos. Minden egyes csomópont a ionrácsos ion-elfoglalt. Példák a nemionos rácsok ábrán látható a 8. és 9. ábrán. 8a ábra a kristályrács a Na + Cl -. Ábra. 8.6 - rács CSJ; Ábra. A 9. ábra a kristályrács CaF2.
A kristályrács Na + Cl - jellemző bináris elektron-trolitov két középre a arcok tömbök vdvi említett egymással ½ hossza a kocka éle. Egy rács - ka-tion Na +. a másik pedig ugyanaz anion C1 -.
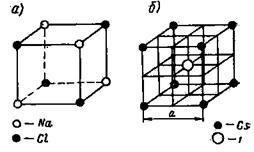
Ábra. 8. A kristályrács NaCl és CSJ
A kristályrács a Cs + J - kombinációja két egyszerű köbös rács: Cs + ion rács és rácsszerkezetű ion J -. Nyomja egymáshoz úgy, hogy a központ a kocka jód-ion, és a sarkokban - ionokat Cs +. Ez a rács közepére van a pro-teret úgy, hogy a központ a kocka egy anion, és a sarkoknál beszélünk-CIÓ.
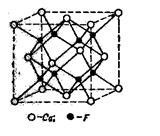
Ábra. 9. A kristályrács CaF2
A kristályrács Ca 2+ F2 - jellemző a sok háromkomponensű elektrolitok. Ahol Ca 2+ ionok kristályalak, a központ-MENT az arcok rács ionok, mint F - felezőpontja található-, próbál nyolc kis kocka, amelyet be kell bomlik nagy kockát.
Az ionos kristályrétegeiben egyes foltok úgy Niemann-kifinomult és komplex ionok. Példák: nátrium-nitrát rácsos Na + NO3 - (9a) és a kálium-hexaklór rács K + [PtCl6] 2- (10. ábra, b.). Itt, az egyes pozíciók által elfoglalt ionok: Na +. K +. NO3 -. [PtCl6] 2-.
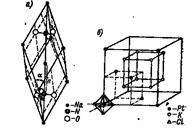
Ábra. 10. A kristályrács a nátrium-nitrát és kálium-hexakloroplatinát.
A kristályrács nátrium nitrátion NO3 egyes - az egyik történik, és a közepén a tetraéder - nitrogénatom N +5. és a sarkok - az oxigén atomok O; atomok össze vannak húzva egymással és a forma tartós, szorosan pántos csoport.
A fenti csoport a tartós komplex iont [PtCl6] 2-. Térben ez a következőképpen van felépítve: a központ a oktaéder - ion Pt 4+. és a sarkok - ionok C1 -.
Ionok [PtCl6] 2- elfoglalják a sarkokban a köbös középre a arcok a kristályrácsban. K + ionok alkotják a kocka.
Molekuláris rács. A molekuláris tömbök foglalnak különböző helyen molekula. Egy példa a molekulaszita csatlakoztatva ?? eny, amelyeket figyelembe vesznek szervetlen kémia, szolgálhat a kristályrács a timföld (ábra. 11 a) és a szén-dioxid CO2 (ábra. 11.6). A kristályrács alumínium-oxid Al2 Oz sarkait rombuszhoz hosszúságú borda # 945; o = 5,12A foglalnak egymáshoz közel egy csoport alkotó atomok egy semleges molekula.
A kristályos középre a arcok széndioxid rácsos pozíciók által elfoglalt külön CO2-semleges molekula. nagyon connivent csoport három szénatomot tartalmaznak, és 2O csoportosítva, amint az a 11. ábrán.
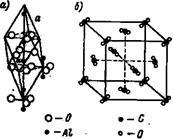
Ábra. 11. A kristályrács az alumíniumoxid és a szén-dioxid CO2
Fém rács. Fémrács karakter alkot különleges tulajdonságokkal, amelyek megkülönböztetik őket más típusú kristályrétegeiben. nem tartalmaz, és a pozitív ionok fém rudak a csomópontok. Külső elektron fématomok vándorolnak belül szabadon kristályrács, újra gyalogos egyik ion a másikba, azaz. E. viselkednek Molek lámák gáz, ezért a összessége az elektronok a fémrács úgynevezett elektron gáz.
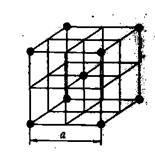
Ábra. 12. A kristályrács fémnátrium
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, fémrács lehet tekinteni, mint egy ionos rács, amely egy elektron gas''atmosfere „” külső elektronok. Azaz, például a nátrium-fémrács (12.). A jellemző tulajdonságai fémek - elektromos és hővezető, különösen függ a mozgás a elektro-új belsejében a rács. Hatása alatt a külső elektromos mező a vegyérték elektronok, amelyek közül fématomok kicsi (1, 2 vagy 3) mozgatjuk a villamos tér irányában, ami az elektromos vezetőképességet.
a különböző iparági raslyah modern berendezések gyártásához nagyon különböző alakú anyagok, a természetes és az ember alkotta. Ebben az esetben, az alapja a modern technológia - a gép-zárására és szőrme - készülnek elsősorban fémből anyagok - fémek, fémötvözetek egymással és a nem-nem-fémek, hogy mielőtt a Sun ?? ez a szén. Ez annak a ténynek köszönhető, hogy a nap ?? ex féle fémből anyagok legértékesebb mechanikai tulajdonságait. Azonban, fémes anyagok számos és változatos st eltérő tulajdonságait.

A folyékony állapotban a legtöbb fém oldódnak egymásban és homogén olvadt ötvözet. Amikor a kristályosodás-TION a megolvasztott állapotból különböző fémek másként viselkednek. A fő esetek az alábbiak:
1. A szilárd állapot nem oldódik Olvasztott fémek és nem reagál kémiailag egymással. Ilyen körülmények között, az ötvözet jelenti mechanikus keverékét, és a következőkből áll krisztallitok Cree-on és más alkatrészek egyértelműen detektálható microsection (13.).
2. kondenzált fémek kölcsönhatásba lépnek egymással, esztergálás-Zuy kémiailag kapcsolt ?? ix.
3. végzett kristályosítás után az olvadék oldhatósága fémek egymással megmarad. A keletkezett kristályokat homogének. Ebben az esetben, a szilárd fázis ismert, mint egy szilárd oldat (ábra. 14). Sőt, bizonyos fémek, valamint kölcsönös oldhatósága szilárd állapotban korlátlan, míg más Ras-oldódik egymásban csak egy bizonyos meghatározott ?? ennyh koncentrációban.
lásd még
Fémek hagyományos gyártási eljárás egy olyan kristályos szerkezettel. Vkristallahatomy található szigorúan rendezett módon, hogy amikor a központokon át egy képzeletbeli vonal mentén három tengely, alkotnak tér (kristályos). [További információ].
A fémes kötés csökkenése miatt az energia a kristály miatt a teljes külső elektron kollektivizálási s, részben p - kagyló. A hidrogénkötés okozza hibridizáció elektronok elektronegatív atomot hidrogénatomok. [További információ].
Zonke (1879), Cermak, Schoenflies Fedorov (1891) és mások kimutatták, geometriailag, hogy az összes kristályos alakban jelen lehet, mint eredményeként a pontok elosztására (a legkisebb részecskék vesche kormányzati) a térben a törvényi szimmetria; get-schiesya konfiguráció hívják. [További információ].
hagyományos előállítási módja a fémek kristályos stroe- készlet. Kristályok atomok szigorúan rendezett módon, hogy ha a központok között egy képzeletbeli vonal mentén a három tengely a koordináta-rendszer, alkotnak egy szóközt. [További információ].