Hogy az atomok és molekulák
Amint a fentiekben említettük, a molekulák állnak atomok. Hány atomok különböző típusai vannak, vagy ahogy ők nevezik kémiai elemek.
Jelenleg ismert 102 elem, hogy töltse ki a sejtek a periódusos Mendeleev.
Az összes különféle anyagok, hogy látjuk a külvilág, vannak kialakítva a kapott vegyületet egymással különböző kombinációi Ezen kémiai elemek (atomok).
A kényelem az írás a kémiai összetétele különböző anyagok és azok közötti kémiai kölcsönhatás kémiai elfogadott a Legend az egyes elemek vannak kialakítva a kezdeti betűk latin nevek ezen elemek.
A latin nyelv, amely eredetileg egy beszélt nyelv az ókori Róma, majd az egész Római Birodalom és később, miután összeomlott a Római Birodalom, továbbra is használják a tudósok a középkorban, és egyes tudományok, ez maradt egészen napjainkig.
Tehát, az orvostudomány a latin nyelv használható a betegség és a gyógyszer nevét a botanika - növény nevét.
Amikor találkozik a kérdésekkel víz kezelés leggyakoribb kémiai elemek alábbi tizenegy:
Ezekkel a jelekkel (karakter) a kémiai elemek is képviseli egy molekula bármely olyan anyag, és a különböző kémiai folyamatok.
A szám a jobb alsó oldalán a szimbólum azt jelzi, a atomok száma a molekulában. Például, a kémiai reakció a tüzelőanyag égés a kazánban jelölhető a következőképpen:
szén-oxigén-szén-dioxid, és a következőképpen szól: körülbelül TSE, plusz két egyenlő körülbelül két TSE.
Kezdeti tudományos feltételezéseket az atom oszthatatlan legkisebb anyagi részecskék hibás volt. Jelenleg fizikusok felfedezték még kisebb elemi részecskék, amelyekből az összes atomok épülnek. Az ilyen mag-részecskéket három protonok, neutronok és elektronok.
A kutatások szerint az elmúlt évtizedekben, amellett, hogy ezeket az alapvető részecskék különböző nyílt több apró részecskék (pozitron, fotonok, neutrínók, mezonok, és mások.) Eredő radioaktív bomlás és átalakulások az anyag.
Hogyan épít egy atom ezen részecskék? A központ minden egyes atom atommag álló protonok és a neutronok. A mag körül forgó különböző távolságokra is (kering) elektronok, amelyek a legegyszerűbb a háromféle részecskéket.
elektron tömege 10 -27 g Proton és neutron közel azonos súlyú, ez körülbelül 1850-szor nehezebb, mint az elektronok. Méretei protonok, neutronok és elektronok vannak kifejezve százezer részvények Á.
A méret a külső forgó pályája elektronok, és amely lényegében akkora, mint egy atom, mint egész, értéke 1 és 4 A. Ezért, a legtöbb a kötet az atom üres, nem töltött számít.
De nem látjuk, nem csak az atomok, hanem a molekulák, így a test körülöttünk úgy tűnik, hogy nekünk épített szilárd anyag.
A fő tömege az atom koncentrálódik a sejtmagban. Ha tudnánk tölteni egy 1 cm 3 protonok és a neutronok olyan erősen, mint azok található atommagba, akkor a súlya a kocka egyenlő lenne körülbelül a súlya a legmagasabb hegy Elbrus kaukázusi. Ilyen sűrűség az anyag a gyomrában néhány csillag.
Protonok és elektronok ellentétes, de azonos mennyiségű elektromos töltés: a proton - pozitív töltés, az elektron - negatív. A neutronok elektromos töltés.
Minthogy általában semleges atom, a száma körül forgó alapvető elektronok száma megegyezik az protonok a sejtmagban. Így, az összes ismert különféle kémiai elemek különböznek egymástól számuk pozitív töltésű protonok sejtmagok és azonos mennyiségű, illetőleg forgó körülöttük különböző pályája a elektronok.
Ábra. A 3. ábra az egyszerűsített áramkör szerkezete az atomok egyes elemek.
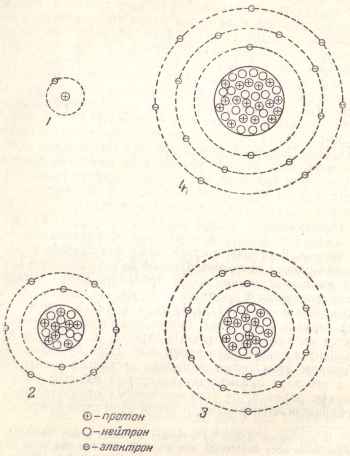
Ábra. 3. Az egyszerűsített áramkör felépítése bizonyos atomok: 1 - hidrogénatom; 2 - oxigénatom; 3 - nátrium; 4 - klór.
hidrogénatom van egy elektron, illetve, és ez a középpontban egy proton. A nucleus oxigénatom nyolc protonok és nyolc elektronok körülvevő, amelynek két elektron forognak belseje mentén az első pályára, és hat elektronok - a külső a második pályára.
Nátrium-Y, amelynek magja 11 és a protonok száma megegyezik elektronok legújabb elosztott három kering: az első - két elektron (valamint az oxigén-atomnál), a második - nyolc elektronok és a harmadik, külső, - egy elektron.
Klóratom protonokkal a sejtmagban 17 van: két elektron az első pályára, hogy a második nyolc elektron pályája (ugyanaz, mint az oxigén és nátrium) és hét elektronok a harmadik pályán.
Azt találtuk, hogy csak egy bizonyos maximális mennyiségű elektront lehet elhelyezni az egyes pályán. Az első pályán rögtön a magot körülvevő, elhelyezésére csak két elektron, a második - a nyolc, a harmadik - negyedik tizennyolc - Harminckét az ötödik - tizennyolc, stb ...
Ebben az esetben az egymást követő elektron pályája lehet csak biztosítani, hogy minden korábbi pályára maximálisan ki van töltve. Azt találtuk, hogy mind a kémiai tulajdonságainak elemek által meghatározott helyét a elektronok és elsősorban elektronok a külső pályán.
Ez a függőség ötletes, hogy előre nagy orosz tudós Mendeleev annak periódusos rendszer elemeinek, ahol a sorszám jelzi a helyzetét az elem elektronok száma per atom. és ugyanabban az oszlopban a táblázat olyan atomok azonos elektronok száma a legkülső pályára.
Mivel ömlesztett koncentrálódik a atommag, majd megmértük a súlyát a tömeg mintegy nucleus álló protonok és a neutronok. neutron tömege némileg eltér a súlya a proton.
A számú neutronok az atommag a protonok száma, vagy kissé meghaladja azt. Így, atomsúlya határozza meg az összes protonok és neutronok a sejtmagban, és ezért nevezik a tömegszáma az atom.
A jelenleg definiált abszolút súlya különböző atomok, azok kifejezése nagyon kis mennyiségben. Például, ha veszel még a legnehezebb atom - urán, súlya mindössze 0,4H10 -21 g
Persze, hogy kezelni az ilyen értékeket a számítás nagyon kényelmetlen. Ezért, a hagyományos kémia elfogadott különleges intézkedést a súly az atomok, egyenlő a súlya a legkönnyebb közülük - a hidrogénatom, amelynek tömege feltételezzük, hogy 1,0, majd a súlya a többi atomok mutatják, hogy hányszor nehezebbek, mint a hidrogénatom.
Jelenleg, az egység a atomsúlyok elfogadott 1/16 atomsúlya oxigén, ami sokkal kényelmesebb, mivel ebben az esetben az atomsúlya sok elemek közel egész számok. De aztán a atomsúlya hidrogén egyenlő 1,008; durva számítás lehet azonos az 1.0.