A függőség hőmérséklet az enzimaktivitás
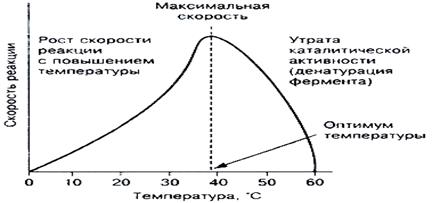
Pripovyshenii hőmérséklet enzimaktivitás meg lett növelve. További növekedése a hőmérséklet rontja a katalitikus képességeit enzim jön hődenaturációs az enzim. Ezért, a függőség a v (T) egy harang alakú, egy éles csökkenést aktivitása magas hőmérsékleten. A termikus stabilitását enzimek a különböző - más. A termikusan instabil vannak. például kináz amelyek elvesztik aktivitásukat 43 ° C-on vannak enzimek stabilak akár 100 C. ilyen stabilitását jellemző a bakteriális DNS-polimerázt alkalmazunk diagnosztizálására DNS (polimeráz-láncreakció, PCR).
A függőség a sebességét az enzimatikus reakció pH:
pH jellemzi a savasság a közeg. Minél alacsonyabb a pH, annál több savas környezet.
Amikor a protonálódás a fehérje megváltoztatja térszerkezetének és enzimatikus aktivitást. A legtöbb enzimek optimális aktivitása pH közel 7 (semleges közegben). Azonban, amint az az ábrán látható az optimális pepszin savas közegben
2), és optimális az alkalikus foszfatáz lúgos közegben (pH =
Amikor egy sav hozzáadását az enzim fordul elő protonálódásának egyes aminosavak. Ez ahhoz vezethet, hogy a változás a térszerkezet az enzim, vagy a módosítások az aktív helyén. Vannak olyan enzimek, amelyek rendkívül érzékeny a pH, és vannak olyanok, amelyek működnek széles pH-tartományban. Képzeld el, az aktív hely az enzim. Feladata, alkalmazkodva a átmeneti állapot egy enzim, hogy minimalizálja az energia az átmeneti állapotát szubsztrátok (aktiválási energia). Ehhez az egész kapcsolatot, meg kell rip feltöltött elektroaktseptornye amino-csoport, és ahol a kommunikáció kell kialakítani - elektron donor csoport. A proteidek enzimekkel kezeljük, enzimatikus katalízissel koenzim részt. Az enzimatikus katalízissel jellemezhető következő megközelítések:
1.Fermenty specifikusan kötődnek szubsztrátumok az aktív oldalon. Így a szubsztrátumok úgy vannak irányítva, hogy megszerezzék a optimális pozícióba a kialakulását az átmeneti állapot.
2. Továbbá, a hidratációs héjat eltávolítottuk szubsztrát. Ez létrehoz egy teljesen más körülmények között, mint oldatban.
3. közötti kölcsönhatás folytán, az aminosav-oldalláncok a fehérje és a szubsztrát komplexet stabilizált átmenet ES.
4. Gyakran végzett proton transzfer. Ez az enzimes sav-bázis katalízis.
5. Gyakran kémiai csoportok kovalens kötéssel kapcsolódnak az enzim maradék. Ezt a jelenséget nevezzük kovalens katalízis.
6. Kölcsönhatás amino gyökök okoznak deformálódik a szubsztrátum (deformáció katalízis), amely megkönnyíti a folyamat áramlási.