St sói hidrolízis
ÖSSZEFOGLALÁS hidrolízis csökkenti kémiai kölcsönhatás a csere kationok vagy anionok sók a vízmolekulákat. Ennek eredményeként ez a kölcsönhatás alakul malodissotsiiruyuschee vegyületet (gyenge elektrolit). A többlet szabad ionok H + vagy OH megjelenik vizes sóoldatban -. és a sók, az oldat színe savas vagy lúgos, ill.
2. képzett sók erős sav és egy gyenge bázis.
Tekintsük hidrolízis-ammónium-klorid, NH4CI.
Két folyamatok zajlanak vizes sóoldatban:
1) minimális reverzibilis vízmolekulák disszociációs (nagyon gyenge amfoter elektrolit), amely lehet írni leegyszerűsítve a következő egyenlettel:
2) teljes disszociációját a só (erős elektrolit):
Így alakult ionok OH - NH4 + és kölcsönhatásban vannak egymással, így NH 3 · H2 O (gyenge elektrolit), míg a H + ionok oldatban maradnak, és ezáltal annak a savas környezetben.
Teljes hidrolízis ionos egyenlet:
A folyamat reverzibilis, a kémiai egyensúly felé tolódik el a kialakulását a kiindulási anyagok, azaz a vizet, hogy a H2 O - .. Az elektrolit jelentősen gyengébb, mint a hidrát ammónia NH3 · H2 O.
Rövidített ion hidrolízis egyenlet:
Az egyenlet azt mutatja, hogy:
1) az oldat szabad hidrogén ionok H +. és azok koncentrációja magasabb lesz, mint a tiszta vizet, így a sót oldat savas közegben (pH = <7);
2) reakciót vízzel részt ammóniumkationok NH4 +; Ebben az esetben azt mondjuk, hogy a hidrolízis a kation.
A reakciót víz is részt vehetnek, és többszörösen töltött kationok: M 2+ kétszeres töltésű (például Ni 2+, Cu 2+ Zn 2+ ..), Más, mint a kationok alkáliföldfémek, háromszorosan M 3+ (például Fe 3 +, Al 3+ , Cr 3+.).
Tekintsük hidrolízis nikkel-nitrát-Ni (NO3) 2.
Ez akkor fordul elő só kation hidrolízissel Ni 2+.
Teljes hidrolízis ionos egyenlet:
Rövid ionos egyenlet:
A hidrolízis termékek - NiOHNO3 bázisos sót és a salétromsav, HNO3.
vizes nikkel-nitrát oldattal savassága a közeg (pH = <7), потому что в растворе увеличивается концентрация ионов Н + .
A hidrolízis NiOHNO3 só keletkezik, hogy sokkal kisebb mértékben, és el lehet hanyagolni. tehát:
1) só A kation, általában reverzibilisen hidrolizál;
2) kémiai reakció egyensúlyi erősen balra mozdult;
3) a reakcióközeget sóoldatokban, például savas (pH = <7);
4) hidrolízisével képzett sók mnogokislotnymi gyenge bázisok, bázikus sók állíthatók elő.
3. alkotott sók egy gyenge bázissal és egy gyenge sav.
Az ilyen sók hidrolízisnek vetjük alá és a kation és anion.
Emlékezni. Képessége és természete hidrolízis határozza meg a bázis jellege és savak, amelyből a só képződik.
Kation gyenge bázis kötődik ionokat OH - a vízmolekulák, amely egy gyenge bázis; gyenge sav anion kötődik H + ionokat a vízmolekulák, amely egy gyenge sav. Reakció megoldások ilyen sók lehetnek semlegesek, gyengén savas vagy gyengén lúgos. Ez attól függ, a disszociációs állandók a két gyenge elektrolitok - savak és bázisok, amelyek hidrolízis útján keletkezett.
Például, úgy két hidrolízise sók: ammónium-acetát NH4 CH3CHOO és formiát ammoniyaNH4 HCCO:
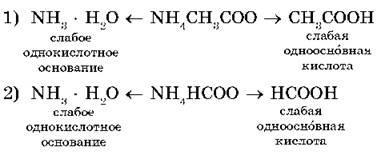
A vizes oldatok ezen sók a kationok NH4 gyenge bázis + reagálnak hidroxidion OH - (Emlékeztetünk arra, hogy a víz disszociál) és anionok gyenge kislotCH3 COO -, és HCOO - kölcsönhatásba lépnek a kationok H + alkotnak molekulákat gyenge savak - ecetsav CH3COOH és hangyasav hangyasav.
Írunk az ion hidrolízis egyenletet:
Ezekben az esetekben, a hidrolízis is reverzibilis, de az egyensúly felé tolódik el a kialakulását hidrolízis termékek - két gyenge elektrolitok.
Az első esetben, az oldatot a semleges (pH = 7), azaz. K. A CD (CH 3 COOH) = KD (NH3 · H2 O) = 1,8 · 10 -5. Az utóbbi esetben a közeg lesz gyengén savas oldattal (pH = <7), т. к. КД (НСООН) = 2,1 · 10 -4 и KД (NH3 · Н2 О) <КД (НСООН), где КД — константа диссоциации.
Hidrolízise legtöbb sók egy reverzibilis folyamat. A kémiai egyensúly hidrolizáljuk csak egy részét a só. Azonban néhány só teljesen bomlik vízben, m. E. A hidrolízis egy visszafordíthatatlan folyamat.
Al2 S3 Alumínium-szulfid alkalmazásával vízben van kitéve visszafordíthatatlan hidrolízis, azaz, hogy jelenik meg, ha a hidrolízis a kation H + ionok megkötik hidrolízisével állítjuk elő; az anion OH ionok .. -. Ez növeli a hidrolízis képződéséhez vezet az oldhatatlan alumínium-hidroxid és hidrogén-szulfid gázzal:
Ezért Al2 S3 alumínium-szulfid nem lehet reakciójával nyert vizes oldatok a csere a két sók, például alumínium-klorid AICI 3 és a nátrium-szulfid Na2 S.
Ennek eredményeként a hidrolízis és kation és anion:
1) Ha a só és a hidrolizált kation és anion reverzibilis, a kémiai egyensúly a hidrolízis reakciók jobbra tolódik; ahol a reakcióközegben, vagy semleges vagy gyengén savas vagy gyengén lúgos, attól függően, hogy az arány a disszociációs állandók a bázisok és savak képződnek;
2) olyan sók, és lehet hidrolizáljuk kation és anion irreverzibilisen, ha legalább az egyik hidrolízis termékek ki a reakció szférában.