készülékek molekulák
Megismerjék berendezés most röviden molekulák, azaz. E. szemcsék, amelyekben néhány atom kombinált. Alapvetően két módja van a kialakulását a molekulák a atomok.
Az első ilyen módszerek alapul előfordulása egy semleges atom elektromosan töltött részecskék. Már rámutatott arra, hogy az atom semleges, azaz a. E. A pozitív töltések száma, melynek magjában (protonok száma) van egyensúlyban száma negatív töltések ,. E. Az elektronok száma kering a magok.
Ha bármilyen okból egy atom veszít egy vagy több elektront, annak mag egy bizonyos feleslege pozitív töltések nem egyensúlyban negatív töltésű elektronok, és így az atom válik pozitív töltésű részecskéket.
Ezek elektromosan töltött részecskék úgynevezett ionok. Ezek elősegítik a kialakulását a molekulák a atomok.
Tanulmány tulajdonságainak különböző kémiai elemek azt mutatja, hogy minden esetben a legstabilabb azok, amelyekben a külső elektron pályája teljesen megtelt, vagy tartalmazza a legstabilabb elektronok száma - 8.
Ez megerősíti a kiváló periódusos, ahol a nulla csoport található leginkább inert (m. E. stabil, és nem lépnek kémiai reakcióba más anyagokkal) elemeket.
Ez egyrészt a hélium, amely egyetlen pályán töltött két elektron és gázok a neon, argon, kripton, xenon és a radon, amely nyolc elektronok a legkülső pályára.
Ezzel szemben, ha a külső pályán atomok csak egy vagy két elektron, ezek az atomok hajlamosak, hogy ezek az elektronok egy másik atommal, ahol a legkülső pályája egy elektron hiányzik 1-2 a száma nyolc. Az ilyen atomok a legaktívabbak reagálni egymással.
Vegyük például egy molekula só. úgynevezett Kémia és képződött nátrium-kloridot, mint a neve is jelzi, a nátrium-és klóratom. A nátrium-atom egy elektront egy külső pályán, míg a klóratom - hét elektronok.
Ha ez a két atom egymáshoz közel vannak, az egyik elektron nátrium, található a legkülső pályán és a gyengén „kapcsolódik” annak atom elszakadhat, és mozgassa egy klórt, amely akkor nyolcadik elektron a külső pályán (Fig. 4 is).
Ennek eredményeként, egy ilyen átmenet van kialakítva két ion: pozitív nátrium ionok és negatív klorid-ion (4b ábra.) Vonzódnak egymáshoz, és amely egy molekula, nátrium-klorid, ami lehet például a két golyó, meghúzni egy rugós (ábra 4 in.) .
A második módszer a képződését molekulákat a atomok áll az a tény, hogy a megközelítés két vagy több ilyen atomok atom a külső pályán elektronok átrendezzük, így válnak kötődik két vagy több atom. Az elektronok, amelyek a belső pályája továbbra is kapcsolatban csak az atom.
Ebben az esetben, ismét, van egy olyan tendencia, hogy létrehozzák a legstabilabb pályája a nyolc elektronok.
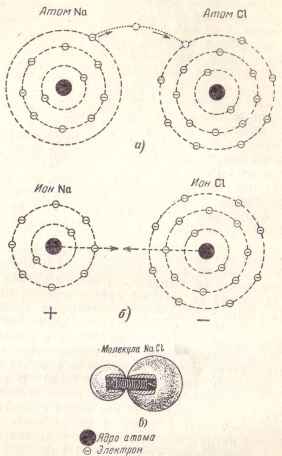
Ábra. 4. reakcióvázlat A molekula nátrium-klorid.
Adunk több példát ilyen molekulák.
Tekintsünk egy molekula szén-dioxid, amely egy szénatomhoz kapcsolódik, és a két oxigénatomot tartalmaz. A formáció ezen molekula következő bekövetkezik újraépítése külső elektron pályája a atomok (5. ábra)
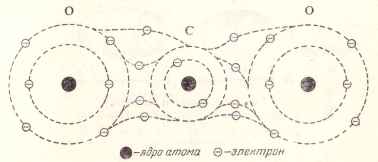
Ábra. 5. ábra a szén-dioxid-molekulák.
szén-tartalékok kapcsolódó magja két elektron a belsejében a pályára, és a négy elektronok, amelyek a külső pályán, osztva két elektron per oxigénatom, amely viszont adott minden két elektront általános kommunikációs szénatomos.
Így minden egyes szén-oxigén kötés kölcsönösen részt két pár elektronok, ahol mind a három atom egy ilyen molekula egy stabil külső pályára, amely a nyolc elektronok keringenek.
Vannak, mint ismeretes, a molekulák nem csak kialakítható különböző elemeket, de az azonos atomok.
A formáció ilyen molekula is köszönhető, hogy a vágy, a fenntartható nyolcszoros az elektronok száma a külső pályán.
Például, egy oxigénatom, amelynek két elektron a belső pályán, és hat elektronok a külső pályán hiányzik két elektron képződéséhez nyolcszorosára környezetben.
Ezért, ezek a két atom amelyekhez kapcsolódnak, egy oxigén-molekula O2. ahol két elektron minden atom -ról, majd körül a külső pályán fog forogni nyolc elektronokat.
A formáció a molekulák a második módszer, amikor egy cseréjét elektronok atomok közötti, a központok atomok szükséges, hogy a megközelítés több, mint az első módszer, ha csak egy kölcsönös vonzás ellentétes töltésű ionok.
Ezért, ha az első módszer lehet képzelni egy ilyen molekula formájában két szomszédos labdák ionok (ábra. 4c), amelyek nem változtatják meg azok mérete és alakja, akkor a második módszer, gömb alakú atomok, mint lapított.
Modern módszerek tanulmányozása az anyagok szerkezetét nem csak tudni, amelyből különböző molekulák állnak atomok, hanem mint atomok elrendezve molekulák, azaz. E. A szerkezet ezen molekulák akár közötti távolság az atommagok az atomok tartalmazza a molekulák.
Ábra. A 6. ábrán a szerkezet a molekulák az oxigén és a szén-dioxid, valamint a helyét a magok az atomok ezen molekulák jelezve az atomi távolságokat Angström.
oxigén molekula áll két atom, akkor formájában két golyó tömörített közötti távolság magok 1,20A atomok. Szén-dioxid molekula, amely a három atom, egy egyenes alakja azzal a szénatommal a közepén, és mindkét oldalán ez egy egyenes vonal két oxigénatom a internukleáris távolság 1,15 A.
Ábra. 6. Struktúrák molekulák: egy - a helyét az atomok; b - a helyét a atommagba; 1 - O2 oxigén molekula; 2 - a szén-dioxid CO2 molekula.