Szervezeti szintek fehérjemolekulák
A patológia fehérje-anyagcsere
Fehérjék - nerazvetvlyayuschiesya polimerek minimális szerkezeti egység, amely - az aminosav (AA).
Aminosavak egymáshoz peptidkötéssel. A fehérje készítmény tartalmaz 20 aminosavas található különböző alfa-formában, de szigorúan meghatározott minden egyes fehérje szekvencia.
Fehérjék organizmus tartalmazhat körülbelül 16% nitrogén, amely bizonyos módszerek egy marker fehérje eredetű anyagok.
Az adatok a teljes mennyisége plazmafehérje (összes vér fehérje) általában úgy állíthatók elő refraktometriai biuret fotometriai módszerekkel.
Humán plazma normálisan több mint 100 típusú proteineket.
Körülbelül 20% az összes fehérje albumin, immunglobulinok, lipoproteinek, fibrinogén, transzferrin és mások.
A normál értékek a teljes plazma-fehérje: 65-85 g / l.
I. A kémiai szerkezet
Alifás § - glicin (Gly), alanin (Ala), valin (Val), leucin (Leu), izoleucin (Ile);
§ hidroxisavak - szerin (Ser), treanin (Thr);
Dikarbonsav § - aszparagin (Asp), glutamin (Glu), aszparaginsav (ASA), glutaminsav (GLA);
§ dibázikus - lizin (Lys), hisztidin (His), arginin (Arg);
Aromás § - feninalanin (Óra), tirozin (Tyr), triptofán (három);
§ Kén - cisztein (Cys), metionin (Met).
II. Szerint a biokémiai szerepe:
§ glükogén - egy sor kémiai átalakítások érkezik glikolitikus anyagcsereút (glükóz oxidációját) - Gly, Ala, Thr, Val, ASK, GLA, Arg, Giese, Meth.
§ ketogén - részt vesz a kialakulását ketontestek - Leigh, Ile, Tyr, hajszárító.
§ Essential - nem szintetizálódik a szervezetben - Gies, Ile, Leu, Lys, Met, hajszárító, Tre, Három, Val.
Jelenlétének köszönhetően a molekula AK egyidejűleg amino- és karboxilcsoportok ezen vegyületek jellemző, a sav-bázis tulajdonságaiban. A semleges közegben AK formájában létezik bipoláris ionok - azaz, ikerionok Nem NH2 - COOH. és NH3 + -R-COO -.
Ha a karboxil-csoport egy aminocsoporton acilezett AK más, alkot kovalens amidkötés, úgynevezett peptid. így peptidek - vegyület képződik a maradék alfa-AK kötve egy peptidkötés.
Ez a kapcsolat stabil és szakadás következik be csak a segítséget katalizátorok - specifikus enzimek. Ezzel kapcsolatban AK egyesült egy meglehetősen hosszú láncok, amelyek úgynevezett polipeptid. Minden ilyen áramkört tartalmaz az egyik végén egy szabad amino-csoportja AA - jelentése N-terminális maradék, és a másik egy karboxilcsoportot - a C-terminális maradék.
Képes polipeptidek spontán módon és megtartása bizonyos térszerkezetet, amely az úgynevezett konformáció, a továbbiakban fehérjék.
Stabilizálása ilyen szerkezet csak akkor lehetséges, amikor elér egy bizonyos hosszúságú polipeptidek, fehérjék, ezért általában úgy polipeptidek, amelyek molekulatömege nagyobb, mint 5000 Da. (1 Igen egyenlő 1/12 a szénizotóp). Csak azáltal, hogy egy specifikus térbeli szerkezete egy fehérje működhet.
1. A strukturális (műanyag), - számos celluláris fehérjék képződött komponensek, és kombinálva lipidek, azok része a sejtmembránok.
2. A katalizátort - az összes biológiai katalizátorokat - enzimek aszerint, hogy azok kémiai természete, fehérjék.
3. Transport - szállítására hemoglobin fehérje oxigént, számos más fehérjék alkotnak komplexet lipidek szállított a vér és nyirok (például, mioglobin, szérum albumin).
4. mechanokémiai - izmos munka és egyéb mozgás a szervezetben végeznek a közvetlen bevonása a kontraktilis fehérjék az energia-energiájú kötésekkel (pl, aktin, miozin).
5. Szabályozási - számos hormon és egyéb biológiailag aktív anyagok fehérje természetű (például inzulin, ACTH).
6. Védő - antitestek (immunglobulinok) olyan fehérjék, továbbá, az alapja a bőr kollagén protein, és a haj - keratin. A bőr és a haj, hogy megvédje a belső környezet a külső hatásoktól. A kompozíció a nyál és ízületi nedv tartalmaz mukoproteidov.
7. Referencia - inak, csontfelszínek vegyületet kialakított kötések nagymértékben fehérjeszerű anyagok (például a kollagén, elasztin).
8. Energia - fehérje aminosav be az utat a glikolízis, amely a sejtet energiával.
9. A receptor - sok fehérje is résztvesz a folyamatokban a szelektív felismerés (receptorok).
Szervezeti szintek fehérjemolekulák
A modern irodalom általában úgy 4 szinten a szervezet felépítését a fehérjemolekula.
A szekvencia aminosavak egymáshoz peptidkötés úgynevezett elsődleges szintű szervezettsége a fehérje molekulák. Ez által kódolt szerkezeti gén mindegyik fehérje. Kapcsolat: peptid és diszulfid-hidak a viszonylag közel elhelyezkedő cisztein maradékok. Ez a kovalens kölcsönhatások, melyek megtörik csak hatására proteolitikus enzimek (pepszin, tripszin, stb).
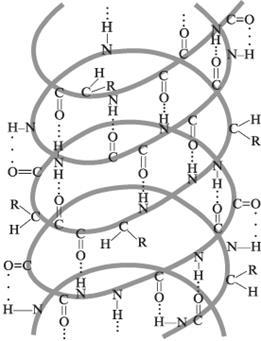
Másodlagos szerkezet nevezik térbeli az atomok elrendezése a fő lánc a fehérjemolekula. Három típusú szekunder struktúrákat, az alfa-hélix, béta-lemez és a béta-kanyar. Van kialakítva és a tartott térben a hidrogén kötések kialakulását az oldalsó csoportok a fő lánc AK. A hidrogénkötések között kialakított elektronegatív oxigén atom, karbonilcsoportok és két amino-hidrogén-atomot.
Alfa-hélix - egy peptid-lánc dugóhúzó spirál körül egy képzeletbeli henger. Az átmérője egy spirál csak 0,5 A. A jobb spirál található természetes fehérjék. Egyes fehérjék (inzulin) két párhuzamos spirális. Béta-lemez - polipeptid-lánc össze az egyenértékű redők. Béta-hajlító - között van kialakítva a három aminosav hidrogénkötéssel. Meg kell változtatni a térbeli elrendezése a polipeptid-lánc kialakítása során a harmadlagos szerkezetét a fehérje.
Tercier szerkezet - egy jellemző fektetési eljárásának fehérje polipeptid-lánc az űrben. Ez az alapja a protein funkciót. Ez biztosítja a stabilitást a kiterjedt részei a protein, amely több aminosavból függő csoport. Ezek a megrendelt térben részletekben képződött protein enzim aktív helyek vagy kötési zónában. Károsodása a harmadlagos szerkezet vezet funkcionális elvesztése a fehérje aktivitását.
Stabilitás a harmadlagos szerkezet elsősorban attól függ, nem-kovalens kölcsönhatások a fehérje belsejében gömböcske - elsősorban a hidrogén kötések, van der Waals erők (ionos vagy elektrosztatikus) és hidrofób kölcsönhatások. Azonban, néhány fehérje tovább stabilizálva kovalens kölcsönhatásokkal, például diszulfid-hidak Mezhuyev cisztein maradékok.
A legtöbb fehérje molekulák régiók alfa-hélix és a béta-lemez. De gyakrabban formájában harmadlagos szerkezetének elválasztjuk globuláris fehérjék - épített előnye alfa-hélix és imeyuscheie gömb alakú vagy ellipszis (legtöbb enzim). És fibrilyarnye - peimuschestvenno álló béta-lemez és amelynek lapos vagy rostos formában (pepszin, fehérjék összekötő Tacna és porc).
Lakóteret kölcsönható alegységek kialakított különálló polipeptidlánc, úgynevezett kvaterner szerkezetét. Ie a kialakulását negyedleges szerkezetét peptid láncok nem vesznek részt a magokat, és a gömböcskék által alkotott minden egyes ilyen áramkörök külön-külön. A negyedleges szerkezet - ez a legmagasabb szintű szervezet a fehérje molekula, és ez inherens nem mindenki fehérjék. Közlemény, alkotó szerkezet a nem kovalens: hidrogén, elektrosztatikus.
Az alapelv a molekuláris biológia. aminosav-szekvenciája a fehérje polipeptidlánc hordozza az összes olyan információt, amely szükséges a kialakulását a specifikus térbeli szerkezetű. Ie rendelkezésre álló aminosav-szekvenciája a fehérje határozza meg a kialakulását alfa- vagy béta-konformációja másodlagos szerkezet kialakulása miatt ezek között a AK hidrogénatom vagy diszulfid-kötés, és a további alkotó globuláris szerkezetet vagy fibrilyarnoy például nem kovalens vzaiomdeystvy közötti oldalsó parcellák bizonyos aminosavakat.
II. Szerint a konformációs szerkezetét:
§ fibrilláris (kollagének, elasztinokat, keratint),
§ globuláris albumin, globulin, hisztonok (minden enzim, és a legtöbb biológiailag aktív anyagok).
III. On kémiai szerkezete:
1. Fehérjék - amely kizárólag az aminosavak.
a) albumin - oldódik vízben, oldódik tömény sóoldatokkal.
b) globulinok - vízben nem oldódik, oldódik sóoldatok.
c) A hisztonok - oldódik vízben, alacsony koncentráció sav. Ezek az erős alapvető tulajdonságait. Ez a nukleáris fehérjék kötődnek a DNS-t és RNS-t.
d) scleroproteins - fehérjék rögzítő szövetek (porc, csont), gyapjút és a szőrt. Vízben nem oldódik, gyenge savak és lúgok.
§ kollagén - a kötőszöveti fehérjéket fibrilyarnye. Hosszan tartó visszafolyató hűtő alatt ezek oldódnak vízben és a gélképző zselatint képződik.
§ elasztin - fehérjék ínszalagok és inak. Szerint a tulajdonságok hasonlóak a kollagén, de vannak kitéve enzimes hidrolízissel szemben az emésztő lé;
§ keratin - egy része a haj;
2. proteidek - mellett AK állnak a nem-fehérje része (glikolipidek, liposzóma, fém, foszfo, nukleotid, chromoproteids)
a) nukleoproteineket - prosztetikus csoport - nukleinsav. A számos osztályok a nukleoprotein riboszómák a leginkább tanulmányozott, amely több RNS-molekulák és riboszomális fehérjék és a kromatin - nukleoprotein core eukarióta sejtekben, amely egy DNS-t és a szerkezetet alkotó fehérjék - hisztonokat (tartalmazott a sejtmagban, és a mitokondriumok).
b) a hem-fehérje - egy nem-fehérje komponense ezen proteidek - hem épített négy pirrol gyűrű a hozzájuk kapcsolódó vasion (a nitrogénatomok). Ezen fehérjék közé tartozik a hemoglobin, mioglobin, citokrómok. Ez az osztály a fehérjék úgynevezett chromoproteids, mivel a hem egy színes vegyületet. Hemoglobin - az oxigén szállítása. Mioglobin - tárolás oxigén az izmokban. Citokróm-(enzimek) - vosstanovaitelnyh katalizáló oxidációs-reakciók és az elektron transzport a légzési láncban.
c) metalloproteinek - a prosztetikus csoport közé tartoznak a fémek. A citokróm és - rezet tartalmaz szukcinát és más enzimek tartalmazhat hemkötésű vas (ferrodoxin) ..
d) lipoproteinek -, lipideket tartalmazó része a sejtmembrán
e) Fosfoproteidy - foszforsavat tartalmaznak maradékot
f) glyukoproteidov - tartalmaz cukrot