szervezeti felépítését a fehérjemolekula szinten, ingyenes dolgozatok, esszék és értekezések
Meg kell jegyezni, hogy a poláris csoportok kölcsönhatásba léphet a vízmolekulák, így nevezik őket hidrofil. Poláros gyökök nem lépnek kölcsönhatásba a vízmolekulák, nevezik őket hidrofób.
Van is egy osztályozása biológiai aminosavak, amely lehetővé teszi annak lehetőségét, hogy ezek szintézisére az a szervezetben. Az összes aminosavat vannak osztva cserélhető (lehet szintetizálni a szervezetben) és a nélkülözhetetlen vagy alapvető (a test nem a szin-teziruyutsya és kell származnia élelmiszer). Néhány alapvető aminosavak tovább módosítható már a fehérjemolekulák, ennek eredményeként a kémiai reakciók, mint például hidroxilezés és metilezés. Például, a kollagén, a hidroxiprolin.
Szokás megkülönböztetni négy szintjét strukturális szerveződése a fehérje molekulák: primer, szekunder, tercier és kvaterner szerkezete. Tekintsük a jellemzőit minden ilyen szinten.
Az elsődleges szerkezet a fehérje egy aminosav szekvencia a polipeptid-lánc az interleaving. Az elsődleges szerkezet mindegyik fehérje egyedi és genetikailag programozott.
Az elsődleges szerkezet egy fehérjét képződött peptid kötések úgy állítjuk elő, # 945; karboxilcsoportja egy aminosav # 945-amino-csoportját egy másik aminosav. A polipeptid-lánc áll rendszeresen ismétlődő részek alkotó főlánc, vagy a peptidváz, és egy változó része, amely egy jellemző oldallánca - amino-csoport.
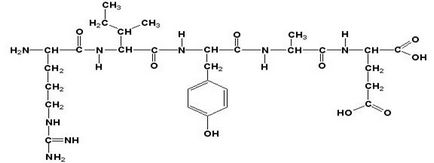
Az aminosav egység peptid (fehérje) nevezzük aminosavmaradékok. Aminosav maradék, amely egy szabad # 945-amino-csoport az úgynevezett N-terminális és a maradékot, amelynek a szabad # 945; karboxilcsoport - C-terminális. A szerkezeti képletek peptidek írt és olvasott az N-végén. Minden aminosavat tartalmazza a polipeptid (más, mint a C-terminális), hogy megkapjuk a végső csoport helyett elérkezhet. A név a peptid - arginilizoleytsiltirozil-glutamát.
Az elsődleges szerkezetét a fehérje, azaz a állítva, és sorrendben az aminosavak meghatározza a váltakozása ő későbbi fiziko-kémiai és biológiai tulajdonságok.
Felderítése aminosav-szekvencia a fehérje érdekes több okból.
Először is, a változást az aminosav-szekvenciája a mutáció megzavarhatja a normális működéséhez a fehérje, és ennek következtében, hogy a fejlesztés a betegség. Ez a súlyos betegség, mint a sarlósejtes vérszegénység az eredménye helyettesítése egyetlen aminosav egyetlen fehérje.
Másodszor, a tudás az aminosav-szekvencia fontos megvilágítását lehetővé tevő molekuláris alapját a biológiai aktivitását a protein.
Harmadszor, egy összehasonlító tanulmány a szekvencia az aminosavak fehérjék lehetővé teszi számunkra, hogy nyomon követni a fejlődését molekuláris szinten.
Negyedszer, meg kell tisztázni az elveket, amelyek alapján a polipeptid láncok képződnek nagyon specifikus háromdimenziós struktúrákat. Azt találtuk, hogy az aminosav-gyök szekvencia a polipeptid-lánc a fehérje hordozza a szükséges információkat generáló térszerkezetében a fehérjemolekula. A folyamat a összecsukható polipeptidlánc a megfelelő háromdimenziós szerkezetet nevezik összecsukható.
Egészen a közelmúltig azt hitték, hogy a kialakulását a térszerkezet a fehérje spontán módon, az hiányában komponens. Azonban, csak a közelmúltban azt találtuk, hogy ez csak akkor igaz, viszonylag kis fehérjék (mintegy 100 aminosav). Nagy a fehérjék térszerkezetének kialakulását igényel speciális -shaperony proteineket biztosít gyors kialakulását a helyes térszerkezet a fehérje.
A másodlagos szerkezete egy fehérje egy eljárás véralvadás a polipeptid-lánc egy spirális vagy más konformáció. Így hidrogénkötések között vannak kialakítva CO- és NH-csoportok a peptid gerincének egyik lánc vagy a szomszédos polipeptid láncok. Számos típusú szekunder struktúrákat, a peptid láncok, amelyek között a fő # 945; spirál és # 946; -skladchaty réteget.
# 945; hélix - merev szerkezet, formája van egy rúd. A belső része ennek a rúd létrehoz egy göndör peptidvázat, az aminosav-gyökök-ny irányban kifelé. Így CO-csoport, minden egyes aminosav reagáitatunk NH-csoport a negyedik maradékot belőle. Az egyik spirál fordulatot 3,6 aminosavat, és a spirális emelkedési 0,54 nm. Bizonyos aminosavak alvadás megakadályozására az áramkörben # 945; spirál, és azok helyét spirál folytonosság megtörik. Ezek az aminosavak közé tartozik a prolin (ott a nitrogénatom része egy merev gyűrűs szerkezet, és a forgatás körül kötés N - Ca válik nem-lehetséges). és az aminosavak, a töltött vagy terjedelmes csoportok, amelyek elektrosztatikus vagy mechanikusan megakadályozzák a kialakulását # 945; spirál.
# 914; -Skladchaty réteg eltér # 945; hélix, hogy van egy sima, nem pedig egy rúd formájában. Alakítunk ki hidrogénkötések belül egy vagy több polipeptid láncot. Peptid láncokat lehet elhelyezni ugyanabban az irányban (párhuzamos) vagy ellentétes irányban (antiparallel). Emlékeztetve a ráncok egy harmonika. Oldalirányú gyökök felett és alatt a réteg síkjából.
A harmadlagos szerkezete a fehérje - az eloszlás térben az összes atomok egy fehérje molekula, vagy más szavakkal, a térbeli csomagolás a spirális polipeptid-lánc. A fő szerepet kialakulását a harmadlagos szerkezetét a fehérje játszanak hidrogénatom, ionos, hidrofób és diszulfid-kötések, amelyek úgy képződnek, hogy közötti kölcsönhatás az aminosav gyökök.
Hidrogénkötések van kialakítva a két poláros gyökök, amelyek közül az egyik lehet egy töltést.
Ionos kötés elvégezhető között ellentétes töltésű gyökök.
A hidrofób kölcsönhatások jellegzetes apoláros gyökök.
Diszulfidhíd képződik a két SH-csoportok a cisztein gyökök található különböző részein a polipeptid-lánc.
Az alakja a molekula és a jellemzőit a kialakulását harmadlagos szerkezet osztva fibrilláris proteinek és globuláris.
Fibrilláris proteinek - van egy rostos formában (szálaktól) képeznek a szálak és fonalak. Két szomszédos polipeptid lánc sok cross-kovalens keresztkötések. Vízben nem oldódik. Oldatba megy akadályozhatják apoláros aminosav gyökök és térhálósító közötti peptid láncokat. A szervezetben működnek, elsősorban szerkezeti funkció, megfelelő mechanikai szilárdságot biztosít szöveti.
Példák fibrilláris proteinek:
Kollagén-fehérje kötőszövet. Összetétele uralják aminosavból, a glicin, prolin, hidroxi-prolin.
Elastin- rugalmasabb, mint a kollagén, egy részét az artériák falában, a pulmonáris szövetek saját aminosav-összetétel uralja glicin, alanin, valin.
Keratin- fehérje származékok epidermisben és a bőr, a szerkezetében túlsúlyban cisztein aminosavat.
Globuláris fehérjék - gömb vagy ellipszis alakú a molekula (gömböcske). Során a kialakulását gömböcskék a hidrofób aminosav gyökök elmerül a belső régiók, hidrofil gyökök található a molekula felszínén. Amikor kölcsönhatásban áll a vizes fázist poláros gyökök képződnek többszörös hidrogén-kötések. Maradt proteineket oldott állapotban miatt a töltés és a hidratációs héj. A szervezetben a globuláris fehérjék végre dinamikus funkciók (szállítás, enzimatikus, szabályozási, biztonság).
Példák a globuláris fehérjék:
Albumin protein vérplazmában; Ez tartalmaz sok maradék glutamát és aszpartát; letétbe 100% ammónium-szulfátot.
Globuliny- plazmafehérjék; összehasonlítva az albuminhoz rendelkeznek magasabb molekulatömegű, és kevesebb, maradékok a glutamát és aszpartát, kicsapjuk 50% telített ammónium-szulfátot.
Gistony- része a sejtmagok, ahol komplexet képeznek DNS. Ezek tartalmaznak sok maradványainak arginin és lizin.
Molekuláris globula száma fehérjék, mint például immunglobulinok állhat több független kompakt összemorzsolt fragmenseit a polipeptid-lánc, amelyek úgynevezett domének. Domain fehérjék, mint egy átmeneti forma a következő szintre a strukturális szerveződése a fehérje.
A kvaterner szerkezetét a fehérje - befogadótér kölcsönható alegységek kialakított különálló polipeptidlánc a fehérje. A negyedleges szerkezet - a legmagasabb szintű szervezet a fehérje molekula mellett opcionális - több mint a fele annak ismert fehérjék. Fehérjék, amely egy kvaterner szerkezetű, más néven oligomer, és a polipeptid-láncok, az alkotó, - az alegységek vagy promoterok. Promoterok lehetnek azonosak vagy eltérőek, ezek primer szerkezetét.
Mind a promoterok szintetizált egyetlen polipeptid-lánc, amely összehajtja egy gömböcske, majd kapcsolódik más promoterok. Ötvözi megy keresztül összeszerelhető. Mind a promoterok tartalmaz részeket, amelyek kiegészítik más protomer. A közötti kölcsönhatás érintkező területei protomerek végzi hidrofób, ionos és hidrogénkötés.
Példák oligomer fehérjék szolgálhatnak fehérje sejtes hemoglobin, a laktát-dehidrogenáz enzim és még sokan mások. Ezek a fehérjék létezhet több stabil konformációban. Fehérjék negyedleges szerkezet, azzal jellemezve alloszterikus tulajdonságokkal, vagyis az a képesség, hogy mozog az egyik konformációban a másikra a változás a funkcionális aktivitását.
További részletes szerkezeti funkció, szervezet oligomer proteinek tekinthetők további példában a hemoglobin.
Egyes fehérjék ismertek, egy olyan molekula, amely két vagy több polipeptid láncot összekötött diszulfidkötések (például inzulin hormon). Az ilyen fehérjék nem tulajdonítható a oligomer. Ezek a fehérjék származnak egyetlen polipeptid-lánc eredményeként részleges hidrolízis - helyi hasítása peptidkötések. Alloszterikus tulajdonságok jellemző oligomer fehérjék, ilyen fehérjéket nem rendelkeznek.