Kémiai kötésre és szerkezete molekulák - studopediya
Under kémiai kötés észre különféle kölcsönhatások, ami a stabil létezését di- és többértékű vegyületek: molekulák, ionok, kristályos anyagok. Természetüknél fogva, a kémiai kötés közötti kölcsönhatás a pozitív töltésű atommag és negatív töltésű elektronok, és az elektron egymással. A főbb típusai a kémiai kötések: kovalens, ionos, fém. Ahhoz, hogy leírják a kovalens kötés két módszerrel - az eljárás vegyértékkötéseket (MBC), és az eljárás a molekulapályák (IMO).
Középpontjában a nap módszer azon alapul, a következő rendelkezések lépnek:
1. A kovalens kötés, amelyek csak két párosítatlan elektront atomok ellentétes centrifugálás (kicserélődési mechanizmusát kötés képződés), vagy egyetlen elektronpárt az atom
- donor és egy szabad orbitális másik atom - akceptor (donor-akceptor mechanizmus).
2.Kovalentnaya kémiai kötés a két atom annak eredményeként jön létre az átfedés az atomi pályák alkotnak elektron párokat (szocializáció két elektron).
Szerint vegyértékkötés elmélet, a kovalens kötés felé irányul a maximális átfedés atomi pályák a kölcsönható atomok.
Geometriai (térbeli) szerkezete egy molekula, amely több mint két atom miatt kölcsönös elrendezése atomi pályák kialakításában játszik szerepet a kémiai kötések. AB2 molekula lehet lineáris. vagy a szögletes szerkezetű (a). AB3 molekula lehet formájában egy egyenlő oldalú háromszög (b), trigonális piramis (c). Molecule AV4 - Tetrahedron alakú (R).
A térbeli szerkezet a molekula típusa határozza meg a hibridizáció vegyérték pályák a központi atom és száma magányos elektron pár tartalmazott egy vegyérték-elektron réteg.
Példa 1. módszer leírásának szemszögéből a vegyértékkötés molekulák szerkezete: a) PH3. b) BBr 3. Mi atomi pályák kialakításában játszik szerepet a kémiai kötések? Típusának megadása hibridizáció (ha hibridizáció történik). Mi a térszerkezet ezen molekulák?
Határozat. a) oktatási PH3 molekula.
Mi írjuk az elektronikus Formula alkotó atomok a molekula PH3, elsősorban (normál) állapotban 15 P 2s 1s 2 2 2 2p 6 3s 3p 3; 1 H-1s 1
Electron grafikus képletek külső réteg az atomok:
Ebben a molekulában, a központi atom foszforatommal, amelyben a kialakulását a három kémiai kötések részt csak p - pályák egyikén elhelyezett alréteg és amelynek ugyanolyan alakja van, és ugyanaz az energia. Következésképpen, a molekulában, hibridizációs PH3 elérhető.
Ahhoz, hogy láthatóvá tegyük a vegyérték rendszerek, akkor a következő módszert. Az elektronok a külső elektron réteg, amelyet egy pont jelöl, körül vannak elrendezve kémiai szimbólum az atom. Közös a két atom elektronokat mutatják pontok között vannak elhelyezve azok a kémiai szimbólumok; kettős vagy hármas kötést, illetve jelöli két vagy három pár közös pontok. Ezekkel elnevezések, oktatás PH3 molekulákat képviseletében a következő:
Ez a rendszer lehet írva másképpen: N - P - H, ahol minden egyes pár elektronok, két atomot összekötő megfelel egy kötőjel képviselő kovalens kötés a szerkezeti képletekben.
p - elektron felhők foszfor atomok vannak orientálva, egymásra merőleges irányban (mentén koordinátatengelyek) -Rh. pv. pz és egy súlyzó alakú. Y hidrogénatom, a kémiai kötés részt P-H s-elektron felhő gömb alakú. Amikor PH3 molekula képződés játszódik átfedés p - elektron felhők foszforatomot, amihez s-elektron felhők a három hidrogénatom:
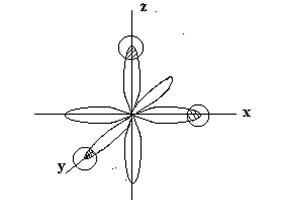
A módszer szerint a vegyértékkötéseket három kötéssel
F - H kell elhelyezni szögben közel 90 ° C-on Következésképpen, a térbeli elrendezése az egyszeres kötések határozza meg a geometriai szerkezet a molekula. PH3 molekulának van egy alakja trigonális piramis:
A tetején a piramis egy olyan foszforatomot, és a bázis csúcsok hidrogénatomok.
b) Oktatási BBr 3 molekula. A molekula BBr 3 központi atom bór atom.
Elektronikus atomok általános képletű:
5 1s 2s 2 2p 2 1 35 2 Br 1s 2s 2p 2 6 2 3s 3p 6 3d 10 4S 2 4p 5
Electron grafikai képletű külső rétege van formájában:
Mivel a bórvegyület háromértékű, levelet elektronikusan grafikai képletű bóratom a gerjesztett állapotban:
A formáció három kémiai kötések a molekulában BBr3-részt az egyik s- és p-pályák a két, található különböző al-szintek és a különböző formájú és különböző energiákkal:
Ebben az esetben, az eredeti helyett két audio s- és p-pályák a gerjesztett bóratom által alkotott három ekvivalens hibrid pályák (SP 2 - hibridizáció). Amikor sp2 hibridizációs hibrid elektron felhők található irányban fekvő egy síkban, és orientált szögben a 120 ° egymással:
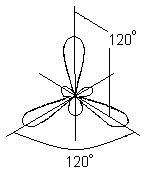
Ez a típus megfelel a kialakulását hibridizációs lapos háromszög molekula. Amikor BBr3-molekula képződés játszódik átfedő három hibrid pályák bóratomot p - elektron pályák három atom brómot:
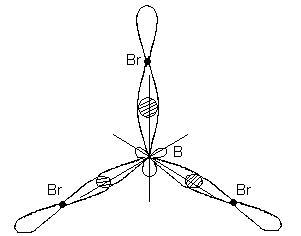
BBr3-molekula az alakja egy lapos derékszögű háromszög, amelynek a középpontja egy bóratomot, és egy felső - a brómatomok. Mindhárom kommunikáció-Br molekulában BBr 3 egyenlő.
2. példa Draw áramkört molekula képződését és F2 F2 + molekulaion módszerével molekulapályák. Hány elektron van a ragasztó és antibonding pályák? Mi a kötés sorrendben ezek a részecskék? Meghatározza azok mágneses jellemzőkkel (paramágnesesség vagy diamágnesség).
Határozat. Az elmélet szerint a molekulapályák (IMO) molekuláról úgy tekintjük, mint egy gyűjtemény pozitív töltésű atommag és negatív töltésű elektronok, az egyes elektron mozog a másik az elektronok és a magok összes.
Egy olyan molekulára az elmélet szerint MMO - ez azt jelenti, hogy milyen típusú a pályák és az energia, és hogy megtudja a karakter az elektron eloszlás a pályák.
A formáció a molekula, amely a molekulapályák kétféle - és szétesés. Ha a kialakulását molekulák atomjainak átmenet egy elektron a molekulapálya lesz csökkenése kíséri az energia, ilyen molekulapálya a kötés. Ha az elektron transzfer molekulapálya kíséri megnövekedett energia, egy ilyen molekulapálya van antibonding.
Elektronok a molekulák található az S- és p- molekulapályák. s-pályák képezhetők átfedő s - átfedése atomi pályák és 2px - atomi pályák. Ebben a formában molekulapályák: s-kötő (SAV) és s-szétesést elősegítő (srazr). Amikor átfedő 2py és 2rz atomi pályák molekulapályák képződnek: psv2Ru. psv2Rz és praz2Ru. praz2Rz. Az, hogy a végeredmény az elektronok molekulapályák ugyanaz, mint abban az esetben, atomi pályák, amely összhangban van az elvet minimális energia, a Pauli-elv, Hund-szabály.