D-elemek távoli tanulságok
Ez a téma gyakran jelent problémát, ha készül a vizsgára. Bár ez nem nehéz.
Tehát először fogok beszélni „a sorsát orosz diákok” - világossá válik, hogy „nő lába” ebben a kérdésben, majd elemzik az anyag maga.
Mindannyian hallottunk a IUPAC (International Union of Pure and Applied Chemistry). 1989-ben az Unió használatra javasolt a világon (és a világ elfogadott és még mindig használja) az úgynevezett „hosszú” formáját a periódusos rendszer:
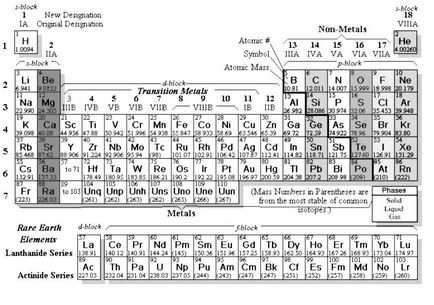
Oroszországban, valamilyen oknál fogva nem használják ....
(Hiányában szín nem figyel - a vizsga adhat egy fekete-fehér változat)
- Nem alcsoportok - egyetlen csoport
- A csoportok száma - 18!
- d-elemek között található az S- és p- elemek (d-blokk)
- illetve a sorozat közben ott van - egyszerűen nem helyénvaló, legyen
Ez a táblázat azt mutatja, a töltés az elektron energia szintet.
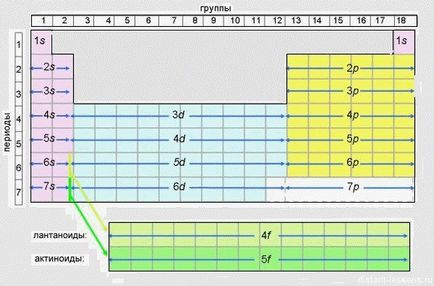
Ez a tabletta ajánlom print és aktívan használják a készítmény a vizsga. A vizsga, persze, akkor meg kell adni egy „rövid” formában, de mire van könnyebb lesz eligazodni rajta.
Szóval, a belépési megértjük, megyünk egyenesen a téma ...
A szerkezet a elektronhéjak atomok
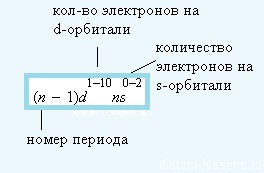
A lehető legnagyobb számú elektronok d-szintalatti - 10,
Jellemzői töltés elektron sublevels:
Felhívjuk figyelmét, Sc - első d-elem és a legtöbb d - alsó réteg kezd megtelni az elektronokkal (s-szintalatti már tele van).
Mi CR hirtelen megjelenik „anomália” - 1 elektron s-szintalatti.
Itt váltott szabály Gunda:
Mozgó pályák kapcsolatos ugyanazon teljesítmény alréteg kezdődik egyetlen elektronok párhuzamos (azonos jel) forog, és csak egyszeri elektronok elfoglalják az összes pályák előfordulhat végső ülepítő elektron orbitálok páronként ellentétes forog. Ennek eredményeképpen, a teljes centrifugálás (és az összeget a centrifugálás kvantum számok) az összes az elektronok a atom maximalizálható.
Nézzük „lefordítani”: minél nagyobb a szám párosítatlan elektronok, annál jobb! 🙂
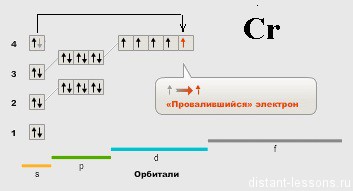
Electron „esik” S - szintalatti a párosítatlan elektronok nagyobb lett.
További időszakban, így a jó - következetesen betöltött d-orbitális elektronok.
V- és Cu-Zn d-alréteg teljesen ki legyen töltve (10 elektronok). Valence elektronok S - alréteg.
A másik elem az is találtam egy ilyen „hiba”.
A következő időszakban nem megyünk bele a részletekbe, én csak így itt a jele az elektronszerkezet d-elemekkel.
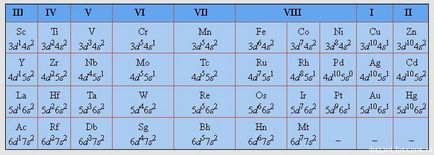
Gyakorlat - be kell mutatnia a saját szerkezete minden egyes ilyen elemek!