elektrokinetikus jelenségek
Különböztesse 4 típusú elektrokin ?? eticheskih jelenségek: elektroforézis, elektroozmózis, a lehetséges áramlás (flow), a potenciális ülepítés (OS ?? edaniya).
Hatása alatt a külső elektromos mező megfigyelt két jelenség:
1. Az elmozdulás a diszpergált fázis a rögzített helyhez képesti diszperziós közeg - elektroforézissel.
2. A diszperziós közeg képest elmozdulnak az álló diszpergált fázis - elektroozmózis.
Phenomenon, fordított elektroforézis és elektroozmózis.
1. az esemény a potenciális különbség, amikor mozog a diszpergált fázis a rögzített helyhez képesti diszperziós közeg - szedimentációs potenciál (?? tengelyek edaniya).
2. Az előfordulása egy potenciális különbség, amikor mozog a rögzített helyhez képesti diszperziós közeg a diszpergált fázis - a potenciális szivárgás.
Az ok elektrokin ?? eticheskih jelenségek kialakulását a villamos kettős réteg, és ennek eredményeként, a jelenléte elektromos töltés, mint a részecskék a diszpergált fázis és a diszperziós közeg a részecskék.
Az érték elektroforézis elektroozmó
Az elektroforézist használják klinikai kísérletekben sok betegség diagnózisát, a partíció ?? eniya aminosavak, nukleinsavak, antibiotikumok, enzimek, vérsejtek, meghatároztuk ?? eniya tisztaságú fehérje készítményeket Hatóanyagok beadására.
Amellett, hogy az orvosi ?? e elektroforézist használnak olyan gyógyszerek adagolásával. A bőrre tampont oldatával megnedvesítjük a gyógyszer preparata͵ és a felső elektródák, amelyre alkalmazzuk alacsony, biztonságos a szervezet potenciális. Részecskék a gyógyszer hatására az elektromos mező a mozgó szövetekben.
Eiektroozrnózist használják víztelenítését különböző porózus anyagok. A nedves masszát helyezünk az elektródok között, és a víz hatása alatt egy elektromos mező alapján az EDL szerkezetet átkerül egyik elektróda és összegyűlik egy speciális gyűjtőedénybe.
Sebesség elektroforézissel (elektroforetikus aktivitás) számítjuk ki a Helmholtz-Smoluchowski egyenlet:

U - sebesség elektroforézis (elektroforetikus mobilitás)
# 949; - dielektromos állandója a közeg
# 958; - elektrokin etichesky lehetséges ??
H - a villamos tér intenzitása
# 951; - a közeg viszkozitása
Az elektromos térerősség arányával fejezzük ki a potenciális különbség, és az elektródák közötti távolság:


A stabilitás diszperz rendszerek
A diszperzió stabilitása érti, hogy képes tartani időt
- átlagos részecskeméret
- ezek egyenletesen vannak elosztva a környezetben IX ??
A diszperz rendszerek Két típusú stabilitást - kin ?? eticheskuyu (ülepítés) és az aggregált.
Kin ?? eticheskaya (ülepítés) jellemzi azt, hogy a stabilitás a diszperz fázis részecskéi szuszpenzióban maradjanak, és nem edat ?? tengelyek alatt a gravitáció hatására.
Összesített stabilitás jellemzi azt, hogy a diszpergált fázis részecskéihez ellensúlyozza azok tapadását egymáshoz és így megőrzik mérete változatlan marad.
Kolloid oldatok stabilitásának közötti közbenső pozícióban durva rendszerek és a valódi oldatokat. Kolloid oldatokat jellemzően sebyasedimentatsionno stabil rendszerek. esedékes
1. A kis részecskeméret
2. az intenzív Brown-mozgás
Az aggregálódásra stabilitás tényezők közé tartoznak a következők:
1. A jelenléte elektromos töltés részecskéket megakadályozza, hogy egymáshoz tapadjanak
2. Az a képesség, hogy oldják az diffúz ellenion réteget; termelt a részecske felületén védőréteg szolvatált ellenionok is megakadályozza azok összetapadását
3. adszorpciója a felületaktív felszínén anyagok (felületaktív anyagok); körül „hidrofil fejek” orientálják a dipólusok felületaktív képződött víz adszorpció eredményeképpen-szolvát rétegen tapadás megakadályozása. Ezt a jelenséget nevezik - „védelmi kolloid”
4. Az a közeg viszkozitása: minél nagyobb a viszkozitás, annál kisebb sebességgel, a részecskék mérete kisebb lehetőség ütközés és a szedimentáció.
Megsértése stabilitásának diszperz rendszerek előfordulásához vezet a koagulációs, valamint további ülepedését diszpergált részecskék.
Koagulációs folyamat úgynevezett adhéziós kolloid részecskék alkotnak nagyobb aggregátumok elvesztése miatt a kolloid aggregációs stabilitás.
Véralvadási okozhat a különböző külső tényezők:
1. A kis mennyiségeinek hozzáadása elektrolit
2. a koncentráció a kolloid oldat
3. A hőmérséklet-változás
4. A hatás az ultrahang
5. A hatás az elektromágneses mező
6. rázás, keverés közben, stb
A biológiai rendszerek, a legnagyobb gyakorlati jelentőséggel a véralvadási elektrolitokat kolloid oldatait sejtek és a biológiai folyadékok érintkeznek elektrolitok.
Minden egyes elektrolitot kell a saját minimális koncentráció az úgynevezett koagulációs küszöbérték vagy koncentrációs küszöbérték (FBS).
A kölcsönös a küszöb a véralvadás, a továbbiakban a kicsapó képesség:

A következő szabályok véralvadási elektrolitok:
1. véralvadási oka ionok, amelyek töltés jele ellentétes töltést pellet. Véralvadási pozitív töltésű szolok okozhat anionok negatív töltésű - kationok.
2. alvadási hatása az ionok, annál erősebb annál nagyobb a költség az ion - véralvadásgátló (Schulze-Hardy szabály)


3. ionok azonos töltésű koaguláló képesség függ a sugár a szolvatált ion: minél nagyobb a sugara, annál kisebb a véralvadási képesség.
Következésképpen, az alkálifém-kationok felírható a következő liotróp sorozat:


A mechanizmusok a véralvadás szerepet elektrolit lényegében abból áll, hogy:
1. A csökkenés bekövetkezhet felületi töltése a szilárd fázis (felületi töltésének a magok), ᴛ.ᴇ. csökkentésével határfelületi (elektrotermodinamicheskogo) épület E.
2. vastagságát csökkentő is előfordulhat diffúziós réteg állandó felületi töltés magok.
Ebben a tekintetben a következőek alvadási elmélet:
1. adszorpció (kémiai) elmélet Freundlich
2. A fizikai elmélet koagulációs DLVO (B. V. Deryagina, Landau, E. Verwey, T. J. Overbeck.)
1. Az elmélet szerint a Freundlich koagulációs bekövetkezik az intézkedés alapján elektrolita͵, hogy a kémiailag kölcsönhatásba lép a potenciális meghatározó ionok, összekötő őket szilárdan csatlakoztatva ?? ix (például fordítására csapadék).
Így, amellett, hogy a pozitív töltésű ezüst-szulfid szol AgJ Kálium-jodid koaguláló K2 közötti S S 2- anionok és kationok a potenciális-Ag + reakció megy végbe: 2Ag + + S 2- → Ag2 S ↓. Ennek eredményeként, a határfelületi potenciális értéke esik, száma ellenionok szükséges, hogy kompenzálja a felelős a magok is csökken, és ennek következtében csökken, és a hidratációs héj körül ionokat, ami tapadását részecskék, ᴛ.ᴇ. véralvadási. Azonban, a csökkent mennyiségű határfelületi kapacitás és magában foglalja a csökkenés # 958; -potential, ᴛ.ᴇ. csökkentése részecske töltés, ami egy csepp ellenállás, ᴛ.ᴇ. véralvadási.
2. Összhangban a DLVO elmélet alvadás hatására elektrolita͵, amely nem lép kémiai reakcióba a PRI és nem változtatja meg a nukleáris díjat.
Ebben az esetben, a koagulációs fellépés mutatnak azok ionokat, amelyek hozzá elektrolita͵ ellenionok micelláris adatok.
Növelése az elektrolit koncentrációja csökken a diffúziós réteg. Határfelületi potenciál azonban változatlan marad, de van egy csökkenés # 958; -potential.
Például: hozzátéve nitrát a szol, pozitív töltésű ezüst-jodid, ezüst-jodidot, amelyek micellák ellenionok NO3 -

Mivel a koncentráció a hozzáadott ionok NO3 - megkönnyítik a bevezetése a diffúz ellenion réteget a adszorbens réteg. Diffúziós réteg összenyomódik, és előfordulhat olyan állapotban, amelyben a diffúz réteg MECS ?? eltűnik, és úgy válik egy elektromosan granulátum, ᴛ.ᴇ. ez lesz az izoelektromos állapotban.
Izoelektromos állapotot nevezik állapotban kolloid részecskék, azzal jellemezve, elektrokin ?? etichesky potenciál (# 958;) értéke 0, és, ĸᴏᴛᴏᴩᴏᴇ irányított pellet hiánya jellemzi a mozgás egy elektromos mező.
Az aggregációs-állandósult érték a kolloid oldat # 958; -potential tartományban van 50-70 mV. A csökkenés # 958; -potential az elektrolit 25-30 mV a rendszerben van-e a külső változás (hologrammképződést színváltozás), mivel a véralvadás aránya nagyon alacsony, így ezt a lépést (I) általában az úgynevezett „látens” koaguláció (rizs) .
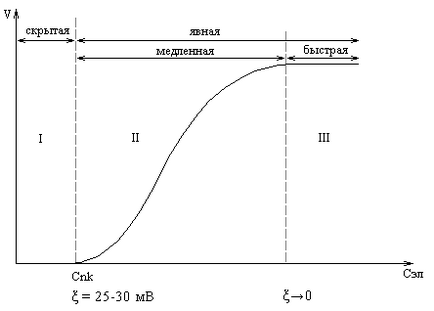
Ábra. Hatása elektrolit koncentráció a véralvadási sebesség
További elektrolit hozzáadásakor a (> CNN) kíséri zavarosodása az oldathoz, és kezdődik a „kifejezett” koaguláció. Kezdetben, a koagulációs sebesség gyorsan emelkedett (II lépés), majd állandó lesz, ha az érték # 958; -potential válik értéke 0, és jöjjön gyors koagulációs lépésben (III).
Koagulációt keverékei elektrolitok
Jelenleg 3 lehetőségeit közötti kölcsönhatás elektrolitok: additív hatás, antagonizmus blues ?? ergizm.
Additivitás - ϶ᴛᴏ összegzése koaguláló hatását az ionok, ami véralvadási.
Egy additív hatás figyelhető meg azokban az esetekben, amikor a elektrolitokat tartalmazó koaguláló ionok, nem reagálnak kémiailag egymással.
Például, különböző sók keveréke KCI, NaNO3 additív hatást eredményez tekintetében mind a negatív töltésű szolok (véralvadási oka K + Na +.), És a pozitív töltésű szolok (oka alvadási Cl -. NO3 -).
Antagonizmus - ϶ᴛᴏ gyengíti a koaguláló, az elektrolit hatásának jelenlétében egymással.
Antagonizmus nyilvánul meg az esetben, ha egy kémiai reakció között elektrolitok koaguláló ionok vannak kötve oldhatatlan csatlakoztatva ?? Űrlapon (csapadék), vagy egy tartós komplex, amely eddig nem koaguláló áramot.
Például, a koagulációs fellépés Pb2 + kationok a kedvezőtlen szolok legyengített jelenlétében NaCl, mint A reakció
Pb 2+ + 2Cl - = PbCl2 ↓
Sin ?? ergizm - ϶ᴛᴏ amplifikációs koaguláló, az elektrolit hatásának jelenlétében egymással.
Sin ?? ergizm lehetséges, ha van egy kémiai kölcsönhatás, ami a kialakulása között, egy többszörös töltésű ion elektrolitok.
Például, a koagulációs fellépés FeCl3 és tiocianát felé pozitív szolok (koaguláló ionok Cl -. CNS -) fokozódik, mert reakció történik
és a kialakulása ionok [Fe (CNS) 6] 3-. amelynek nagy kicsapó teljesítmény.
Az elektrolitok a gyógyászati ?? e, elengedhetetlen, hogy fontolja meg a véralvadás biológiai mintákban, mint például a bevezetése a különböző gyógyszerek a test injekcióval tudni kell, hogy ezek az anyagok szin ?? ergistami hogy elkerüljék az esetleges véralvadási.
Csoportja esetében az úgynevezett koagulációs kolloid oldatok tartalmazó heterogén részecskék, eltérő kémiai természete, vagy egy jel értéke ?? th töltés.
Egy különös eset csoportja esetében a kölcsönös véralvadási - összeolvadásának ellentétes töltésű kolloid részecskéket. Amikor ez bekövetkezik, a teljesebb véralvadási, annál teljesen semlegesítjük a díjak a kolloid részecskék (szemcsék díjak).
Peptizálása úgynevezett fordított folyamat a véralvadás - iszap átalakítási folyamat által képzett koaguláció stabil kolloid oldatot.
Peptizálása gyakorlatban elvégzett két módja van:
1. a csapadék mosása tiszta oldószerrel ?? cm (diszperziós közegben), ami kioldódását ionok, ami véralvadási.
2. Hozzáadjuk speciális elektrolit - peptizátoraként, ionok, melyek adszorbeálódnak a részecske felületén csökken ionos atmoszférában részecskék körül.
A szükséges feltételek peptizálása:
1. peptizálása csak frissen csapadék óta Hosszú tárolási vezet koaguláltató részecskék kicsapása fokozatos tömörítés és annak elmozdulását a folyékony fázis szerkezetét.
2. Kis mennyiségű elektrolitot (különben bekövetkezik koaguláció)
3. Keverés megoldás
Kolloid elleni védelmet növeli az aggregált stabilitás liofil szolok által Hozzáadunk haditengerészet.
A mechanizmus a védőhatása lényegében abból áll, hogy a vizes oldatban a kolloid IUD amfifil molekulák felületén adszorbeálódott a kolloid részecskék vannak irányítva, hogy a hidrofób részükkel a diszpergált fázis részecskéinek, hidrofil - víz. Ennek eredményeként, a részecskék felületén válik borított liofil és kiegészítő szolvatáció héj.
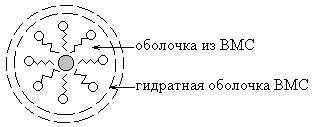
Tekintettel a vizes kolloid oldatok rendelkeznek jó védőhatást a vízben oldódó fehérjék. Így a vér proteinek gátolják csapadékként kivált és ?? eniyu koleszterin a falakon az erek, és a kalcium-sók.
Kolloid védelmet használnak előállítására stabil liofil szolok gyógyszerekként hasznosíthatók. Például, egy kolloid ezüst és Protargolum tartalmaznak erősen diszpergált fém ezüst, védett makromolekuláris csatlakoztatva ?? eniyami.
lásd még
Annak vizsgálata a szerkezet a micellák Kimutatták, hogy egy elektromos kettős réteg képződik a felületen a liofil kolloidok. Az első elmélete a szerkezet a DES által kifejlesztett Helmholtz és Perrin; a saját képviselete az elektromos kétrétegű kondenzátor, mint a lapos. [További információ].
A diszpergált fázis a kolloid oldatok részecskék bonyolult szerkezetű. Ezek az úgynevezett - micellák. Liofil kolloidok feltétlenül igényli az elektrolit jelenléte speciális stabilizátort. stabilizáló ionok adszorbeált a részecskék. [További információ].