Alapegyenletének MKT gázok
A legegyszerűbb modell a molekuláris kinetikai elmélet, egy modell az ideális gáz. A kinetikai modell az ideális gázmolekulák kezelik tökéletesen rugalmas golyó, és kölcsönhatásban áll a falak csak a rugalmas ütközések. A teljes mennyiséget minden molekulák feltételezzük kis mennyiségéhez képest az edény, amelyben a gázt. A modell ideális gáz leírja elég jól viselkedését reális gázok széles nyomások és hőmérsékletek. Cél molekuláris kinetikai elmélet az, hogy kapcsolat jöjjön létre a mikroszkopikus (súly, sebesség, kinetikus energia a molekulák) és makroszkopikus paraméterek (nyomás, térfogat, hőmérséklet).
Ennek eredményeképpen, minden ütközés a molekulák közötti és a molekulák a falak a molekulák sebessége változhat nagyságú és irányban; időközönként idő egymást követő ütközés molekulák mozgó egyenletesen és egyenes vonalú. Az ideális gáz modell feltételezi, hogy minden ütközés sor törvényei szerint a rugalmas ütközés, t. E. vonatkozó törvényi szabályozás a newtoni mechanika.
A modell az ideális gáz, kiszámítja a gáznyomás az edény falához. Kölcsönhatás során a molekula az érfal közéjük, erők ébrednek szófogadó Newton harmadik. Ennek eredményeként, a vetülete a sebessége a molekula υx, merőleges a falra, megváltoztatja a jele, hogy az ellenkező, és a nyúlvány υy sebességű párhuzamos a fal, változatlan marad (ábra. 3.2.1).
Elasztikus ütközés a fal a molekula
Ezért a változás lendületét a molekula egyenlő 2M0 υx. ahol m0 - tömege a molekula.
Isolate a falra egy bizonyos területen S (ábra. 3.2.2). Alatt dt ezen a területen szembe kell néznie az összes molekula kiálló υx sebességet. felé a fal, és továbbra is a hengerben, hogy a bázis S és υx At magasságú területet.
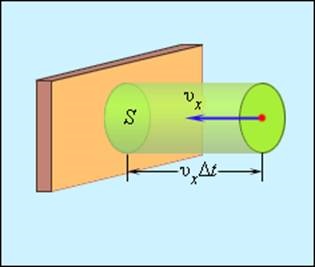
Meghatározása közötti ütközések számát molekulák helyén S
Legyen egységnyi térfogatú az edény tartalmaz N molekulákat; akkor a molekulák száma a a henger térfogata egyenlő nS υx dt. De ez a szám csak a fele mozog a fal felé, a másik fele mozog az ellenkező irányba, és a fal felé nem. Következésképpen, az ütközések számát a molekulák a terület S egyenlő egy időben dt
Mivel minden egyes molekula esetén ütközés a fal megváltoztatja a lendület az összeg 2M0 υx. A teljes változás lendület összes molekula összeütköző során At egyenlő platform S.
Szerint a mechanika törvényei változás történik a lendület ütközik a falon a molekulák zajlik befolyása alatt impulzus erő F dt. ahol F - néhány átlagos ható oldalfalán a molekula a helyszínen S. De a 3. Newton ugyanaz abszolút erő hat a részét a molekulák a földre S. Ezért tudjuk írni:
Osztása mindkét oldalról S dt. kapjuk:
ahol p - gáznyomás az edény falához.
A levezetés ezen összefüggésben feltételezzük, hogy az összes n-molekulák egységben foglalt térfogatú gázt, a nyúlványok azonos sebességgel az X tengely A valóságban ez nem.
Ennek eredményeként több ütközések között gázmolekulák egymással és a falak egy hajó, amely nagy molekulák száma, be van állítva egy statisztikus eloszlását a sebesség. Ebben az esetben, az összes irányban vektorok molekuláris sebességek egyenlők (egyformán valószínű), és a modulok a sebesség és a nyúlványok a koordinátatengelyeken vannak kitéve bizonyos törvények. A eloszlása a gázmolekulák nevezik modulo Maxwell sebességeloszlás. Dzheyms Maksvell 1860-ban hozott törvény elosztási gázmolekulák felett sebességek alapján az alapvető rendelkezéseket a molekuláris kinetikus elméletét. Ábra. 3.2.3 görbék képviselője a sebesség eloszlás. Az abszcisszán az a sebesség modul, és az ordináta - relatív molekulák száma, akiknek a sebességek a tartományban legfeljebb υ υ + δυ. Ez a szám megegyezik a kiemelt területen látható. 3.2.3 oszlopot.
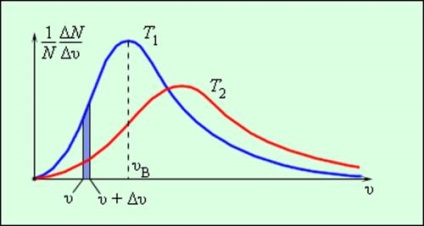
A forgalmazás molekuláris sebességek. T2> T1
Maxwell eloszlás jellemző paraméterek a legvalószínűbb sebesség υv. megfelel annak a legnagyobb az eloszlási görbe és az RMS sebessége
- az átlagos négyzetes sebesség.
Növekvő hőmérséklettel, a maximális az eloszlási görbe eltolódik a nagyobb sebesség, míg υv és υkv növekedése.
Annak tisztázása a képlet a nyomású gázt a tartály falával, feltételezzük, hogy minden molekula tartalmaz egy egységnyi térfogatban, csoportokra osztjuk, tartalmazó n1. n2. n3 és m. g. molekulák kiemelkedések υx1 sebességgel. υx2. υx3 és t. d., ill. Ebben az esetben,
Minden csoport molekulák hozzájárul
gáznyomás. Ennek eredményeként a ütközések falának molekulák különböző értékeit a teljes nyomás a nyúlványok bekövetkezik sebessége υxi
Ebben a kifejezésben összeget - a négyzetének összege a nyúlványok υx minden n molekula térfogategységére jutó gáz. Ha ez az összeg osztva n. megkapjuk az átlagos négyzetes a vetülete a sebessége molekulák:
Ez az egyenlet létrehozza a kapcsolatot közötti p nyomás ideális gáz, a tömege m0 a molekula. koncentráció n molekulák. az átlagos értéke a sebesség négyzet és az átlagos kinetikus energiája transzlációs mozgás a molekulák. Ez az úgynevezett alapvető egyenlet molekuláris gázok kinetikus elméletét.
Így, a gáz nyomása megegyezik az kétharmada az átlagos kinetikus energiája transzlációs mozgás a molekulák az egység által tartalmazott mennyiség.
A alapegyenletének molekuláris gázok kinetikus elméletét tartalmaz a termék koncentrációja n molekulák átlagos kinetikus energiája transzlációs mozgás. Feltételezve, hogy a tárolt gáz a tartályban állandó térfogatának V.
(N - molekulák száma az edényben). Ebben az esetben a nyomás változás AP arányos a változás az átlagos kinetikus energia.
A kérdés: hogyan lehet megváltoztatni a tapasztalat az átlagos kinetikus energiája molekulák mozgásának egy edényben állandó térfogatú? Mi a fizikai mennyiség kell változtatni változtatni az átlagos kinetikus energia tapasztalat azt mutatja, hogy ezt a mennyiséget a hőmérséklet.
A hőmérséklet fogalma szorosan kapcsolódik a fogalom a termikus egyensúly. A testek érintkeznek egymással, megoszthatják energiát. Az átadott energia egy másik test termikus kapcsolatban, az úgynevezett hőmennyiség.
Termikus egyensúly - egy állami rendszer testek, amelyek a termikus kapcsolat, amelyben nincs hőátadás egyik testből a másikba, és minden makroszkopikus paramétereinek szervek változatlan marad. Hőmérséklet - ez egy fizikai paraméter, amely megegyezik az összes szervek termikus egyensúlyban. Bevezetésének lehetőségét a hőmérséklet fogalma legyen a tapasztalat, és az úgynevezett zéró főtétele.
Mérni hőmérsékletet fizikai eszközök - hőmérők. amelyben a hőmérséklet értéke alapján ítélik meg a változás egy fizikai tulajdonság. Ahhoz, hogy hozzon létre egy hőmérőt kell választania termometriás anyag (például higany, alkohol) és termometriás értéket. jellemző tulajdonsága egy anyag (például, hossza a higanyt vagy alkohol oszlop). A különböző konstrukciók hőmérők használni a különböző fizikai tulajdonságai az anyag (például, változások a lineáris méretei szilárd vagy változás a villamos ellenállása vezetékek melegítéssel).
Hőmérők kalibrálni kell. Erre a célra hozták be ezeket termikus érintkezésbe a szervekkel, hogy az említett előre meghatározott hőmérsékleten. A leggyakrabban használt egyszerű természetes rendszerek, amelyekben a hőmérséklet állandó marad, annak ellenére, hogy a hőcserélő a környezettel - a reakcióelegyet jég és víz keverékével víz és gőz forralással légköri nyomáson. A Celsius hőmérsékleti skála jég olvadáspontja tulajdonítják, hogy a hőmérséklet 0 ° C és a víz forráspontja - 100 ° C-on Megváltoztatása a hossza a folyadékoszlop a kapilláris hőmérő egyszázad hosszának védjegyek közötti 0 ° C és 100 ° C-on vesszük egyenlő 1 ° C-on Egyes országokban (US) széles körben használják Fahrenheit (TF), ahol a fagyasztási hőmérséklete vizet vesznek egyenlő 32 ° F, és a víz forráspontja egyenlő 212 ° F. ezért
A különleges helyet foglal el a fizika foglalnak gáz hőmérő (ábra 3.2.4.), Amelyben a termometrikus anyag ritkított gáz (hélium, a levegő) egy edényben az állandó térfogatú (V = const), egy termometriás mennyiség - a gáz nyomása p. A tapasztalat azt mutatja, hogy a gáz nyomása (a V = const) növekszik a hőmérséklet növelésével, mért Celsius skálán.
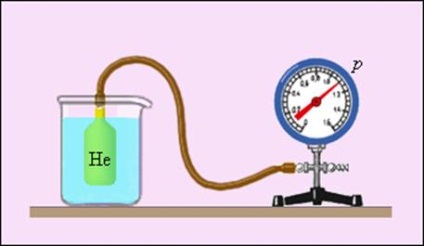
Angol fizikus William Kelvin (Thomson) 1848-ban javasolta a használatát nulla gáznyomás pont az épület egy új hőmérsékleti skála (Kelvin-skála). Az ilyen méretű, a hőmérséklet mérő egység ugyanaz, mint a Celsius skála, de a nulla pont tolódik:
Az SI mértékegység elfogadott Kelvin és Kelvin hőmérsékleten hívást betűvel jelöljük K. Például, szobahőmérsékleten TA = 20 ° C Kelvin egyenlő TC = 293,15 K.
Kelvin hőmérsékleti skála hívják az abszolút hőmérsékleti skála. Ez a legkényelmesebb az építési fizikai elméleteket.
Nincs szükség kötni a Kelvin-skála két fix pont - olvadáspontja jég és a víz forráspontja légköri nyomáson, amint ez szokásos a Celsius skála.
Szintén gáznyomás nulla pont, amely az úgynevezett abszolút nulla hőmérséklet. elég ahhoz, hogy egy másik fix viszonyítási pont. A Kelvin-skála mint ilyen használunk szempontjából vízhőmérséklet a hármas pont (0,01 ° C), ahol mind a három fázis termikus egyensúlyban - jég, víz és gőz. Kelvin hőmérséklete a hármas pont feltételezzük, hogy 273,16 K.
Gáz hőmérők nehézkes és kényelmetlen a gyakorlati használatra: használják őket, mint standard precíziós kalibrálására egyéb hőmérők.
Így a nyomás a rarefied gáz egy hajó állandó térfogatú V egyenesen arányos az abszolút hőmérséklet: p
T. Másrészt, a tapasztalat azt mutatja, hogy állandó térfogatú V és T hőmérséklet gáznyomás változása egyenesen arányos az anyag mennyiségét arány ν a tartályban, hogy a V térfogata az edény
ahol N - molekulák száma a hajó, NA - Avogadro-szám, n = N / V - molekuláris koncentráció (azaz, a molekulák száma egységnyi térfogatban a hajó ..). Ötvözi ezeket a kapcsolatokat az arányosság, írhatunk:
ahol k - egy univerzális állandó a gázokat. Ezt nevezik a Boltzmann állandó. tiszteletére az osztrák fizikus Lyudviga Boltsmana, egyik alapítója a molekuláris kinetikus elméletét. Boltzmann állandó - az egyik alapvető fizikai állandók. A számérték SI:
k = 1,38 · 10 -23 J / K.
Arányt összehasonlítjuk p = NKT az alapvető egyenlettel molekuláris gázok kinetikus elméletét, állíthatjuk elő:
Az átlagos kinetikus energiyahaoticheskogo mozgása gázmolekulák egyenesen arányos az abszolút hőmérséklettel.
Így, a hőmérséklet olyan intézkedés az átlagos kinetikus energiája transzlációs mozgás a molekulák.
Meg kell jegyezni, hogy az átlagos kinetikus energiája a transzlációs mozgás egy molekula független a tömegét. Brown részecske szuszpenzióban a folyadék vagy gáz ugyanolyan átlagos kinetikus energiája, különálló molekulaként melynek tömege sok nagyságrenddel kisebb, mint a tömege Brown részecskék. Ez a következtetés vonatkozik arra az esetre, ahol a hajó kémiailag kölcsönhatásba nem lépő gázok keveréke, a molekulák, amelyek különböző tömegeket. A egyensúlyi állapot molekulák különböző gázok azonos átlagos kinetikus energiája hő-mozgás határozza meg csak a keverék hőmérséklete. Nyomás gázkeveréket az érfal áll a parciális nyomások az egyes gázok:
Ez az arány n1. n2. n3. ... - molekuláris koncentrációja különböző gázok a keverékben. Ezt az összefüggést fejezi ki a nyelvet a molekuláris kinetikus elméletét kísérletileg létrehozott elején a XIX században, Dalton-törvény: a nyomás a keverék kémiai kölcsönhatásba nem lépő gáz összegével egyenlő a parciális nyomás.