A alapegyenletének ICB és hőmérséklet mérés
Tanulási folyamatok előforduló statisztikai rendszerek, a minimális szemcseméret bonyolult és nagy részük. Tekintsük külön minden egyes részecske gyakorlatilag lehetetlen, azonban bevezetni statisztikai mennyiségek: az átlagos sebessége a részecskék, ezek koncentrációja, a részecske tömegét. Formula jellemző a rendszer állapotának a mikroszkopikus paraméterek, az úgynevezett alapvető egyenlet molekuláris gázok kinetikus elméletét (ICB).
Egy kicsit az átlag részecskék sebessége
Meghatározó a részecskék sebességét az végeztük először kísérletileg. Ismert a tananyag kísérletet Otto Shternom, hozhatnak létre egy képet a részecskesebességeket. A kísérlet vizsgált a mozgás a ezüst atomok forgó hengerek: első helyhez kötött telepítés, majd amikor ez forog egy bizonyos szögsebességgel.
Ennek eredményeként azt találtuk, hogy az arány a ezüst molekulák meghaladja a hangsebesség, és 500 m / s. Az a tény, elég érdekes, mivel az ilyen részecskék sebessége anyagok egy személy úgy érzi, nehéz.
ideális gáz
Ahhoz, hogy továbbra is tanulni lehetséges csak a rendszerben, a paramétereket, amelyek meghatározzák a közvetlen mérések alapján a fizikai eszközök. Sebesség mérése sebességmérő, de az ötlet, hogy csatolja a sebességmérő egyetlen részecske abszurd. Közvetlen mérésére csak makroszkopikus kapcsolatos paramétert a részecskék mozgását.
Bármely rendszer kölcsönható testek jellemzi a potenciális energia és a kinetikus mozgási energiája. Valódi gáz - egy komplex rendszer. A változékonyság a potenciális energia dacol rendszerezése. Problémát meg lehet oldani bevezetésével egy modellt, a jellemző tulajdonságait a vivőgáz elsöpri összetettsége kölcsönhatás.
Az ideális gáz - a halmazállapot, amelyben az interakció részecskék elhanyagolható, a potenciális kölcsönhatás energiája nullához. Ez csak akkor tekinthető jelentős mozgási energiával, ami függ a részecske sebességét.
Ideális gáz nyomás
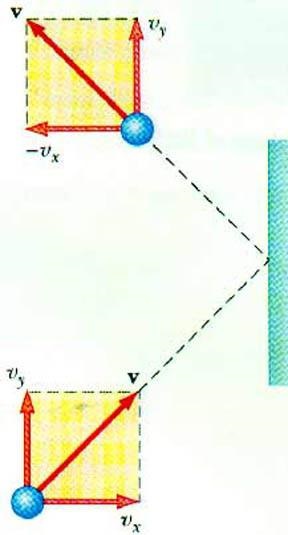
Határozza meg a kapcsolatát gáznyomás és a részecskék sebességét az lehetővé teszi, hogy annak alapvető egyenlet MKT ideális gáz. A mozgó részecske egy edényben, a ütközés a fal akkor továbbít egy impulzus, amelynek értéke alapján határozzák meg a II Newton:
Megváltoztatása a részecske lendülete rugalmas társuló sokkot a változás a vízszintes összetevője a sebességét. F - által kifejtett erő a részecskéket a falon egy rövid időre t; M0 - részecske tömege.
A felszínen S idején At felé eső összes gázt mozgó részecskék a felületi irányában sebességgel VX és elhelyezve a henger térfogatának Sυx dt. Amikor a részecskék koncentrációja n pontosan a fele molekulák mozog a fal, a második felében - az ellenkező irányba.
Figyelembe véve az ütközés a részecskék, írhatunk Newton a ható erő platform:
Mivel a gáz nyomás a meghatározás szerint az arány a ható erő merőleges a felületre, az utolsó terület felírható:
Ez összefüggéssé mint alapvető ICB képes leírni a teljes rendszer, azaz. K. A mozgás csak az egyik irányban.
Maxwell eloszlás
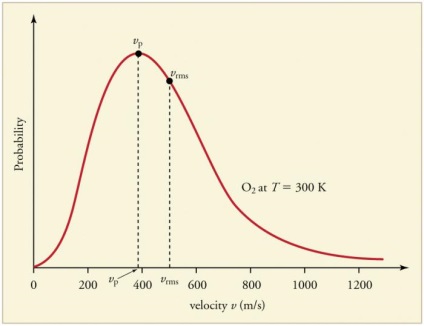
Állandó gyakori ütközések a gáz részecskék a falak és egymást vezet a létesítmény egy bizonyos statisztikai eloszlása a részecske sebességének (energia). Irány a sebességvektorokkal egyformán valószínű. Ez a felosztás már az úgynevezett Maxwell eloszlás. 1860-ban, ez a minta származik J. Maxwell alatt ICB. A fő paraméterek eloszlásának törvény az úgynevezett sebesség: valószínűleg megfelel a maximális érték a görbe és az átlagos négyzetes VKV = √‹v 2 › - átlagos négyzetes részecskék sebessége.
A növekedés a gáz hőmérséklete növekedésnek felel meg a sebesség értékek.
Azon a tényen alapul, hogy az összes sebesség egyenlő, és ezek modulok azonos jelentésű lehet tekinteni:
- ‹v 2 › = ‹vx 2 › + ‹vy 2 › + ‹VZ 2 ›hol: ‹vx 2 › = ‹v 2 ›. 3
Alapegyenletének MKT az átlagolt értékei gáznyomás formájában:
Ez a kapcsolat egyedülálló abban, hogy ez határozza meg a kapcsolat a mikroszkopikus paraméterek: sebesség, részecske tömege, szemcsék sűrűsége és a gáz nyomása, mint egy egész.
A koncepció a kinetikus energia a részecskék, alapegyenletének MKT lehet átírni:
A gáz nyomása arányos az átlagos értéke a mozgási energiája a részecskék.
hőmérséklet
Érdekes, hogy a konstans mennyiségű gáz a zárt edényben is csatlakoztatható a gáz nyomása és az átlagos energia a részecske mozgás. ahol a nyomás mérés végrehajtható mérésével az energia a részecskék.
Hogyan lehet nevezni? Mit lehet mennyiségéhez viszonyítva a kinetikus energia? Ez a mennyiség az a hőmérséklet.
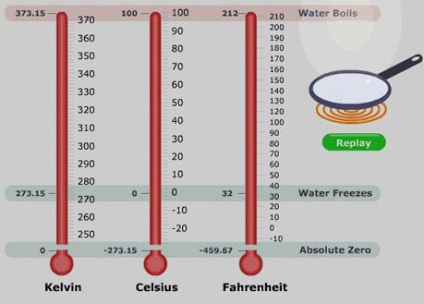

Univerzális hőmérséklet
További érdekes szempontjából függetlenségét a dolgozó tulajdonságai a test lehet tekinteni, mint egy gáz hőmérő. A tartomány nem függ a gáz típusát. Egy ilyen eszköz lehet megkülönböztetni hipotetikusan a hőmérséklet, amelynél a gáz nullához nyomást. A számítások azt mutatják, hogy ez az érték megfelel -273,15 ° C hőmérséklet-tartományban (abszolút hőmérséklet mértékét vagy a Kelvin-skála) vezették be 1848-ban évente. A lényeg ez a skála került nulladik gáznyomás lehetséges hőmérséklet. Scale intervallumon megegyezik az egységnyi érték Celsius. Record alapegyenlete segítségével ILC hőmérséklete sokkal kényelmesebb tanulmányozásában gáz folyamatokban.
Kommunikációs nyomás és hőmérséklet
Empirikusan biztosítani lehet a gáz nyomása arányos annak hőmérsékletét. Ugyanakkor megállapították, hogy a nyomás egyenesen arányos a részecskék koncentrációja:
ahol T - abszolút hőmérséklet, K-állandó egyenlő 1,38 • 10 -23 J / K.
Az alapvető érték, amelynek állandó érték minden gázra, az úgynevezett Boltzmann állandó.
Összehasonlítva a nyomás és a hőmérséklet függvényében alapegyenletének MKT gázok felírható:
Az átlagos értéke a kinetikus energia a gázmolekulák mozgás arányos annak hőmérsékletét. Azaz, a hőmérséklet olyan intézkedés a kinetikus energia a részecske mozgás.
