A törvény a Maxwell eloszlás molekuláris sebességek
4.§ törvény Maxwell sebesség eloszlás és az energia
A forgalmazás törvénye ideális gázmolekulák a sebesség elméletileg kapott Maxwell 1860-ban határozza meg, egy molekulák száma dN homogén (p = const) egyértékű ideális gáz a teljes N számának a molekulák egységnyi mennyiség egy adott hőmérsékleten a T a sebességet az intervallum V és V + dv.
Levezetéséhez molekuláris sebességeloszlás f (V) arány egyenlő a dN molekulák. sebességek a tartományban v ÷ v + dv molekulák a teljes N számának és az értéke dv intervallum
Maxwell használt két javaslat:
a) minden irányban a térben egyenlő, és ezért minden mozgás iránya a részecskék, azaz bármilyen sebesség irány egyformán valószínű. Ez a tulajdonság néha tulajdonát izotróp eloszlásfüggvény.
b) mozgása mentén három egymásra merőleges tengely, amelyek függetlenek x-komponense sebesség nem függ az értékek vagy annak komponense. És akkor a kimenet f (v) egy első egyetlen komponenst. majd általánosítása minden koordináta sebességet.
Úgy gondoljuk továbbá, hogy a gáz áll, egy nagy N számú azonos molekula állapotban random hő mozgás ugyanazon a hőmérsékleten. Forcefields gáz nem működnek.
Funkciók F (v) meghatározza a relatív molekulák számát dN (V) / N aránya amelyek fekszenek a tartományban térfogat: térfogat + dv (pl gáz N = 10 június molekulák, ahol dN = 100
molekuláknak sebessége v = 100 V + dv = 101 m / s (dv = 1 m) abban az időben.
A módszerek a valószínűség elmélet, Maxwell talált egy f (V) - a törvény eloszlása a molekulák egy ideális gáz sebessége:
F (v) függ a gáz típusától (tömeg molekula) és az állami mennyiség (hőmérséklet T)
F (v) arányától függ a kinetikus energia a molekula megfelelő nagysága a vizsgált sebesség kT jellemző átlagos hőenergia a gázmolekulák.
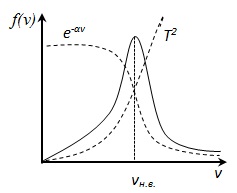
. Ezért, a hőmérséklet növekszik legvalószínűbb sebesség nő, de a görbe alatti terület S. eloszlásfüggvény változatlan marad, mivel a normalizáció feltétel (mert a valószínűsége, hogy egy bizonyos esemény egyenlő 1), így amikor a hőmérséklet emelésével eloszlási görbe f (v) nyúlik vagy csökken .
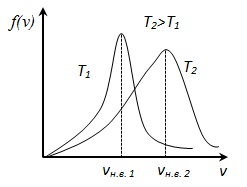
Ezután a számtani középértékét molekulák sebessége
és integrálja a részek
Speed jellemző gáz halmazállapotban
5. § A kísérleti igazolása a törvény Maxwell eloszlás - tapasztalat Stern
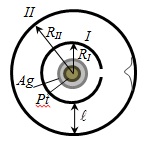
Hasított kapott kép elmosódik. Megvizsgálva a kicsapódott réteg vastagsága lehet becsült eloszlását a sebesség, amely megfelel egy maxwelli eloszlása.
§6 A légköri képletű
Még mindig úgy tekintenek a viselkedése ideális gáz, nem befolyásolja a külső erőtér. A tapasztalat azt jól ismert, hogy az intézkedés a külső erők, a részecskék egyenletes eloszlását a térben lehet osztani. Így, az intézkedés alapján a gravitáció molekulák hajlamosak aljára süllyednek az edény. Intenzív hőmozgás megakadályozza ülepítés és molekulák elosztott, hogy azok koncentrációja fokozatosan csökken a növekvő magasságú.
Származhat törvény nyomásának változását magassága feltételezve, hogy a gravitációs tér egyenletes, a hőmérséklet állandó, és a tömege az összes molekulák azonosak. Ha a légköri nyomás a h magasság egyenlő p. majd a h magasság + dh egyenlő p + dp (DH> 0, dp <0, так как p уменьшается с увеличением h ).
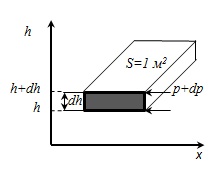
sűrűsége a h magasság. és ettől. it = const.
Egyenletből Mengyelejev-Clapeyron.
Propotentsiruem a kifejezés (
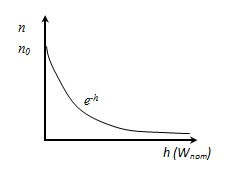
Légköri képlet, azt mutatja, hogy a nyomás változik a magassággal
.
n sűrűségének molekulák h magasságban,
0 n sűrűsége molekulák a magassága h = 0.
A potenciális energia a molekulák a gravitációs tér
Boltzmann eloszlás egy külső potenciál területén. Ebből az következik, hogy ha T = const gáz sűrűsége nagyobb, ha kevesebb, mint a potenciális energia a molekulák.
§7 kísérleti meghatározása az Avogadro-állandót
J. Perrin (francia tudós) és 1909-ben tanulmányozták viselkedését Brown részecskék az emulzió gumigyanta (fanedvek) méretben vizsgáltuk mikroszkóppal, amelynek volt egy mélységélesség - 1 mm. Mozgó a mikroszkóp függőleges irányban lehetséges volt, hogy vizsgálja meg a eloszlása Brown részecskék kiigazítás.
Alkalmazni rájuk a Boltzmann-eloszlás felírható
n = - ahol m a tömeg egy részecske
m - tömege a kiszorított folyadék:
Ha n 1 és n 2 koncentrációja részecskék szinteken H 1 és H és 2. k = R / NA. az
Az érték jó egyezést mutat a referencia értéket, amely megerősíti a Boltzmann-eloszlás a részecskék