A gyógyszerek hatását a sejtek
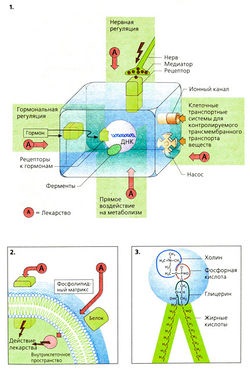
Farmakológiai hatások a sejtek szintjén
A cél a gyógyszeres kezelés célja, hogy megszüntesse a tünetek hatva mechanizmusok annak előfordulása. A sejt a legkisebb szerkezeti egység egy életképes organizmus. A külső sejtmembrán - plazmapemma - választja el a cellát az extracelluláris környezetből származó, szükséges fenntartani homeosztázis a sejt. Kicserélődési folyamatokat a sejt és a külső környezet vezérli ágyazott által a sejtmembránon transzport fehérjék, mint például az energia-függő szivattyúk (például Na / K-ATFa-ben), a szállítási rendszerek (kotranszport glükóz) vagy ioncsatornákat (Na-csatorna; Ca-csatorna) (1).
A funkcionális koordináció cella alapján meglétét az egész szervezetre. Management celluláris funkciók segítségével citoszol kapcsolatok és hírvivő anyagok, amelyek információt továbbítani. Ők kerülnek a idegvégződések „adó”. A felszínen a sejt membránok gyógypedagógia, észrevette információk receptorokhoz. A jelző anyagok közé tartoznak a hormonok is kiválasztódik endokrin mirigyek és jön sejtek a vérben és az extracelluláris folyadék. Signal anyagokat is felől a szomszédos cellákban: parakrin hatás (kibocsátás a belső elválasztású mirigyek lokálisan hatóanyagok, mint például a prosztaglandinok).
A hatás a gyógyszer gyakran határozza meg annak hatását a sejtek működését. Sites gyógyszer hatásának lehet receptorok (antagonisták vagy agonisták). Változások a aktivitásának membrán transzport rendszerek is befolyásolja a működése a sejtek (szívglikozidok, kacsdiuretikumok, kalciumcsatorna-blokkolók). Gyógyszerek járhat intracellulárisan, befolyásoló celluláris metabolizmus, például gátolják az enzimek (foszfodiészteráz-inhibitor), vagy aktiváló őket (szerves nitrát) (2); befolyásolhatja a sejtmagban (DNS-károsodás citosztatikumok).
Gyógyszerek, hogy egy intracelluláris hatásmechanizmusa, kell áthatolni a sejtmembránon.
A sejtmembrán egy foszfolipid kétrétegű membrán (vastagsága
50 A = 5 nm), amely magában foglalja a membránba ágyazódott fehérjék, mint például a receptorok vagy transzportfehérjék. Foszfolipid-molekulák tartalmaznak két hosszú láncú zsírsavak kötött glicerinné annak két hidroxilcsoportot tartalmaz. A harmadik hidroxilcsoport kapcsolódik glicerin-foszforsav-, amelynek kapcsolat egy másik molekularészhez, például kolin (Phos-fatidilholin, t. E. lecitin), aminosav-szerin (foszfatidil-szerint) cukor vagy inozit (foszfatidil-inozit). A megoldások foszfolipidek mutatják amfifil tulajdonságokkal miatt, a nem poláros molekulák - szénláncú zsírsavak - a lipofil és a hidrofil poláris fej. Ezért foszfolipid molekulák „automatikusan” kialakul kétrétegű: poláros fej kifelé nézzenek, hogy a poláris vizes környezetben, és egy zsírsav lánc befelé sejtek (3).
A hidrofób belső réteg egy foszfolipid membrán impermeábilis poláros vegyületek (diffúziós gát). Nem-poláros vegyületek könnyen átjutnak a membránon, ami nagyon fontos a belépés, eloszlását és kiválasztását gyógyszerek.
Gyógyszerek hatását a sejtekre [szerkesztés]
A legtöbb molekuláris célpontok társított különböző komponensei a biokémiai mechanizmusokat a celluláris válasz (G-fehérjék, enzimek, ioncsatornák, stb). Ezt a kapcsolási reakciót nevezzük transzdukció.
G-fehérje-kapcsolt transzdukciós [szerkesztés]
G-fehérjék - molekulák közvetlenül kapcsolódik egy meghatározott csoportját receptorok vagy közvetve más molekuláris célpontok. Az aktivált G-protein iniciálja (vagy elnyomja) a különböző szakaszait celluláris reakciók, hogy végső soron megváltoztatja a funkciója ioncsatornák, enzimek, DNS-t és más celluláris komponensek, mint például a K + csatorna nyílás a szívizom kötődés után muszkarinos acetil-kolin-receptor-aktivitást vagy növelhetjük protein- kináz kötődés hatására az adrenalin β-adrenoreceptor.
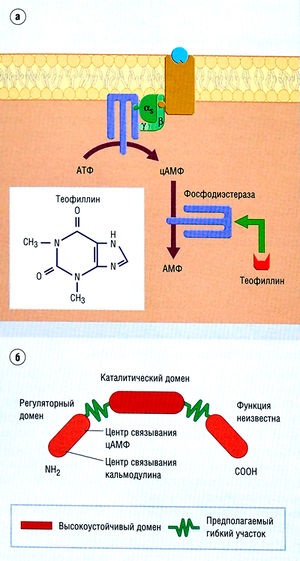
Ábra. 2,25 példa transzdukció kezdeményezett enzimet.
G-protein, amely három alegységből - egy, β és y-sejtek, és működik, mint egy kapcsoló jel (ábra 2.25).
Aktiváláskor agonista G-protein-kapcsolt receptor konformációs változások a receptor felelős aktiválása G-protein, ami a kilépési guanozin-difoszfát és a guanozin-kötő zintrifosfata (GTP) és az a-alegység és disszociációja a alegységek a heterodimer βu. A- és βy-alegység aktiválja transzdukciós komponensek. a-alegység hidrolizálják GTP GDP, ami viszont, inaktiválja a-alegység, segít helyreállítani a kapcsolatát a βu-komplex és a inaktiválása a G-proteint.
Stimulálása vagy gátlása G-fehérje révén a modulációs enzimatikus rendszerek termelésért felelős transzdukció következő komponensek (néha a másodlagos hírvivők):
- ciklikus nukleotidok;
- diacilglicerol;
- inozitol.
Például, aktiválása β2-adrenerg receptor aktiválja a G-protein. Ez viszont aktiválja az adenilil-cikláz - olyan enzim, amely katalizálja a cAMP képződését. Transduction megy végbe a cAMP aktivizálása miatt protein-foszforilációs enzimtípusokat függ az anyag fajtájától.
A sejtek, több altípusa G-proteinek. egy-altípus meghatározza a fő jellemzői a G-protein. Például, β-adrenerg receptorok általában kölcsönhatásba a G-fehérjék hordozó AS-alegység, amely aktiválja az adenilil-cikláz.
Leírás ábra. 2,25 példa transzdukció kezdeményezett enzimet. Foszfodiészteráz enzimek (ek) részt vesz az anyagcsere a ciklusos nukleotidok (például, cAMP). Ez a csoport az enzimek gátolja a teofillin. Gátlása felhalmozódásához vezet a ciklikus nukleotidok a sejtben (b). Vegye figyelembe, hogy ciklikus nukleotidok felhalmozódnak válaszul a hatása nukleotid gyógyszerek enzimek társított a C-protein. AMP - AMP; ATP - adenozin-trifoszfát; cAMP - ciklikus adenozin-monofoszfát.
Ca2 + -Knit transzdukció [idézet]
Mobilizálja a sejten belüli Ca2 + mint második messenger - Az utolsó láncszeme a reakciók termelő komponensek transzdukció.
Ion Ca2 + részt vesz a jelátviteli az alábbi eljárások:
- simaizom-összehúzódás;
- gyorsulás kontrakció és a relaxáció a kardiális-izomsejtek;
- neurotranszmitterek szekrécióját és mirigyek szekrécióját;
- hormon;
- sejttoxicitásról
- aktiválása bizonyos enzimek.
A mozgósítása Ca2 + aktivitás társul transzdukcióját egyéb tartozékok. Ca2 + felhalmozódik az endoplazmatikus retikulumban a simaizom és az intézkedés alapján az IP3 egy adott RSK úgynevezett IP3 receptor.
Kibocsátási DAG történik azáltal, hogy közvetlenül a foszfolipáz C (vagy D) aktivitását egy membránhoz kötött protein-kináz C, amely foszforilációját szerin és treonin oldalláncok és ezt követő aktiválását a több mint 50 különböző fehérjéket. Legalább hatféle protein-kináz C, amelyek mindegyike a szubsztrát specifitás.
Action fő G-protein
- Gs stimulálja adeiililtsiklazu és aktiválja a Ca2 + csatornákat
- Gi gátolja adeiililtsiklazu és aktiválja a K + -csatornák
- Gq aktiválja a foszfolipáz C
- Ide gátolja a Ca2 + áram
- Gt serkenti adeiililtsiklazu szemét
- GDF serkenti orr adeiililtsiklazu
- β-, és alegység aktiválja sok komponens a transzdukció
Transduction összefüggésben vannak a protein-kináz C [szabály]
A protein-kináz C fontos eleme a transzdukciós a következő reakciók:
- endokrin moduláló felszabadulását hormonok és neurotranszmitterek;
- simaizom-összehúzódás;
- gyulladás;
- ion szállítás;
- a tumor növekedését.
Transduction kezdeményezett DNS-kötött receptorok [idézet]
Az aktiválás a DNS-kötött protein transzdukciós magában foglalja a szintézisét egy változás. Például, a szteroidok mozgatjuk, és a HSP90 által képzett komplex a szteroid receptor a sejtmagba. A sejtmagban a szteroid-receptor komplex lehet megkülönböztetni specifikus bázis szekvencia és aktiválja specifikus gének. Ez a folyamat lassabb, mint a milliszekundum megfigyelt válaszok más formái transzdukció. Például:
- szteroidok növeli a termelést a lipokortin, ami megmagyarázza a gyulladásgátló hatás;
- mineralokortikosteroidy növelik a vesében a specifikus molekulák részt tubuláris transzport ionok Na + és K +.
Transduction által kezdeményezett receptorok tirozin-kináz aktivitást [szabály]
Aktiválása a receptor tirozin kinázok lehetővé teszi autofoszforilezését tirozin maradékok, amelyek központjaiként szolgálnak a különböző szelektív intracelluláris fehérjék. A foszforilezett receptor, mint a platform kötődését más fehérjék, ami foszforilációját és aktiválását a kaszkád komplex reakciók mint más protein-kinázok. Sok a képződött reakció hasonló reakciók által kezdeményezett G-proteinek.
Sok a tirozin-kináz-receptorok kötőhelyeket más fehérjék jelátviteli. Az egyik ilyen kötőhelyek nevezzük SH2. Csatlakozás a SH2 inaktív enzim igen szelektív enzim aktiválásával. Gyakran aktivált részt vevő enzimek gén transzkripciót. Számos protein-kinázok, IP3 és a Ca2 + részt vehet a közbenső szakaszaiban transzdukció. Sok növekedési faktorok ezzel a mechanizmussal. Ezzel kapcsolatban érdekes a gyógyszerek fejlesztését, amelyek kölcsönhatásba lépnek SH2 vagy ismétlődő tevékenység SH2, mivel ezek a gyógyszerek befolyásolják a sejtnövekedést és differenciálódást, ezért lehetséges, hogy az ilyen gyógyszerek rák, immunológiai betegségek, és más betegségek. A részt vevő proteinek a transzdukciós révén tirozin-kináz-receptorok közé tartoznak a kis G-protein Ras.
Transduction kezdeményezett RSK [idézet]
Amikor az RNC kezdeményez transzdukció, kiváltott válaszul változások miatt a membránpotenciál társított növekedés (vagy csökkenés) a permeabilitást az ionok, amelyek áthaladnak az RNC. Így, transzdukció kezdődik a töltés megváltozásával, ami depolarizáció vagy hiperpolarizáció a membrán. A tipikus lokalizációja DGC egy plazma membrán, de a RAC is megtalálható a mitokondriumokban és egyéb intracelluláris organellumok.
A változás a membrán potenciál közvetlenül képes a szövetek funkcióját. A vázizom nikotinos aktiválását RAC véglemez depolarizálja a membránt, és ebből következően a szarkoplazmatikus retikulum (miután a termelési kapacitás az szarkolemma), ami a kimenet a Ca2 + a citoplazmában és izomösszehúzódások.
Példák integrációja celluláris és molekuláris mechanizmusok [idézet]
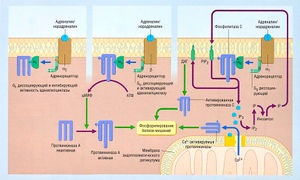
Ábra. 2,26 traisduktsii Többféle vezethet foszforilációja a fehérjék.
Néhány példa az integráció a sejt- és molekuláris mechanizmusok ismertetjük (ábra. 2,26). Az arány a transzdukciós és a szöveti válasz meghatározása molekuláris célpontja (receptor) és a transzdukciós mechanizmust. Ez az arány határozza meg az elején a szöveti válasz. Például:
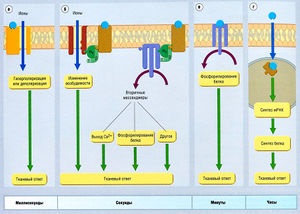
Ábra. 2.27 A kapcsolat a molekuláris és celluláris mechanizmusok
- agonista kölcsönhatás RAC vezet gyors (milliszekundum) depolarizáció vagy a sejt hiperpolarizációját;
- agonista kölcsönhatásban van a G-fehérjéhez kapcsolt receptor eredményezhet egy a sok válaszok tartós másodperc;
- reagáltatjuk a gyógyszer közvetlenül az enzim vezethet változásokat néhány perc alatt;
- reagáltatjuk a hatóanyag közvetlenül a DNS-t módosítják a génexpressziót és a szintézis egy új fehérje, több órán át. Példák közötti integráció molekuláris és celluláris válaszokat ábrán mutatjuk be. 2,26, 2,27, 2,28.
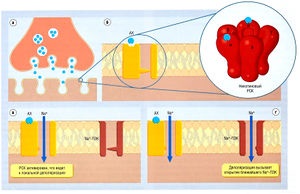
Ábra. 2,28 példa transzdukció kapcsolatos receptorhoz kapcsolódó ioncsatorna
Leírás ábra. 2,26 traisduktsii Többféle vezethet foszforilációja a fehérjék. A ciklikus adenozin-monofoszfát (cAMP) és a foszfatidil-inozitol fontos alkotórészeit transzdukció (másodlagos hírvivők). cAMP termelés megnőtt aktiválására adott válaszként számos C-fehérje-kapcsolt receptorok (például, aktiválás vagy a2 Rrretseptorov epinefrin, amint az a központ a szám miatt agonizmus p-adrenoceptor). A protein-kinázok (például, protein kináz A) és aktivált cAMP másodlagos hírvivők részt vesz a celluláris választ. Bizonyos típusok agonizmus (például aktiválása a2-adrenoceptor agonisták) gátlásához vezet cAMP termelés aktiválása miatt gátló G-fehérjék (Gi) (bal felső részén az ábrán). Foszfolipáz C enzim (lokalizált a sejtmembrán) aktiválja egy agonista, valamint a másodlagos hírvivők LNS (l, 4,5) P3 (inozit-1,4,5-trifoszfát, 1R3) és diacil-glicerinné (DAG) (jobb panel). Intracelluláris 1R3 kimenetek intracelluláris Ca2 +, míg a DAG a membránon marad, ami aktiválja a protein-kináz C-1R3 vetjük alá későbbi orilezzük intracelluláris foszfatázok alkotnak IP2, IP és az inozit, amely azután lépett a membrán képez foszfatidilinozitol (PI), amely foszforilezett keresztül az adenozin-trifoszfát (ATP) fosfatidilinozitoldifosfata (R1R2). Daylight 1R3 és a DAG PI blokkolja a lítium, amely csatornába inozitolovye lipidek az agyban. Lítiumot alkalmaztunk, mint a kezelés a mániás depresszió (lásd CHAP. 8). Gs - stimuláló G-protein.
Leírás ábra. 2.27 A kapcsolat a molekuláris és celluláris mechanizmusok, (a) Nagyon gyors transzdukció kapcsolatos receptorhoz kötött csatornák, (b) Gyors transzdukció kapcsolatos a C-protein. (C) Lassú transzdukció kapcsolatos enzimek és szivattyúk, (g) Nagyon lassú transzdukció kapcsolatos dezoxiribonukleinsav. mRNS - messenger ribonukleinsav.
Leírás ábra. 2,28 példa transzdukció kapcsolatos receptorhoz kapcsolódó ioncsatorna (ek), válaszul az elektromos impulzus jön az idegvégződésekben, vezikulumok acetilkolin (ACh) egyesül a membrán terminális lemezt, ami az ACh felszabadulását a szinaptikus résben, (b) ACh kötődik egy receptor helyén a-alegységében a receptorhoz kötött csatorna (RAC), okozza azt, hogy nyissa, és következésképpen, a bemeneti és kimeneti Na + K +, ami a helyi depolarizációs (c). Depolarizáció kezdeményezi transzdukciós, hogy vezet a nyitó Na + -n3K a szomszédos területeken a membrán vázizom, ami egy további bemenetére a Na + és kiváltó kiterjedt depolarizáció aktiváció és a Ca2 + -PZK összehúzódása az izomrostok (g). USC - feszültség-függő csatornájára.