(B) az atom szerkezete
1. AZ ENERGIA MINIMUMJA ALAPELVE
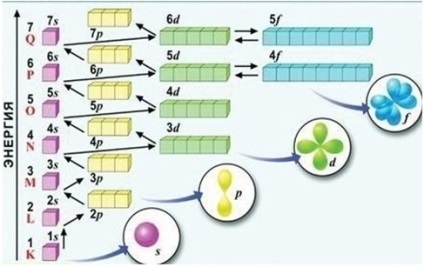
Az orbitálok az energia növekvő sorrendben vannak kitöltve, alulról felfelé. Minden elektron úgy helyezkedik el, hogy az energiája minimális, azaz a szabad pályák között a legkisebb energiát választja.
Az energiaszintek feltöltésének sorrendje (lásd az ábrát) A következő sorozatok memorizálhatók: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d » 4f <6p <7s….
2. POLITIKAI ELV
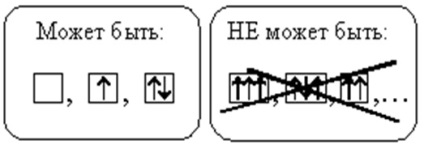
Minden pályán nem lehet több, mint két elektron. Ha két elektron ugyanabban az orbitálisban van, akkor ellentétes pörgetéssel rendelkezik (a nyilak különböző irányúak). Az ilyen elektronokat párosnak hívják. Ha az orbitálison csak egy elektron van, akkor párosulnak hívják.
3. HUNDA (GUNDA) SZABÁLYA
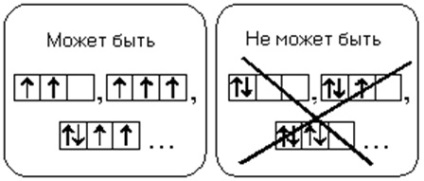
Egy földalatti atomnak rendelkeznie kell a párosított elektronok maximális lehetséges számával egy bizonyos alsó szint alatt.
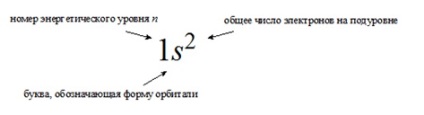
Az atom elektronikus képletje az elektronok eloszlása az atomok vagy azok ionjainak földi (nem kimutatott) állapotában lévő orbitálisok felett
AZ ELEMEI ELEKTRONIKUS KONFIGURÁCIÓÁNAK ÉPÍTÉSÉRE VONATKOZÓ ELVEK
Egy elem atomjában lévő elektronok száma megegyezik annak sorszámával.
Az atom energiaszintjeinek száma megegyezik annak a periódusnak a számával, amelyben az elem található.
A külső (valence) szinten lévő elektronok száma megegyezik azon csoport számával, amelyben az elem található.
Az elektronikus konfiguráció részletesebb leírása során nem csak az adott energia szintjén lévő elektronok számát, hanem az eloszlást is figyelembe vesszük az alsó szinteken. Minden fel nem töltött orbitális egy üres térrel van jelölve.
AZ ATOM ELEKTRONIKUS KONFIGURÁCIÓJA
Az atomok részletes elektron konfigurációi kétféleképpen ábrázolhatók:
grafikusan, nyilakkal ellátott négyzetekkel (gyakran energia diagramokkal);
a sorban, amikor az összes elfoglalt energiaszintet fel kell sorolni, mindegyikük elektronszámainak feltüntetésével.
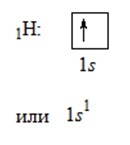
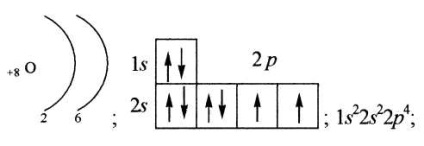
Egy atom valenciáját a páratlan elektronok száma határozza meg.
Szabad orbitálok jelenlétében az atom elektronjai bomlanak, ugorhatnak egy másik alsóbb szintre, azaz az atom egy izgatott állapotba kerül, így a valencia állandó és változó lehet. Ebben az esetben a páratlan elektronok száma, és következésképpen az atom által létrehozott kötések száma növekszik.
A legmagasabb érték mindig egyenlő a csoport számával (kivétel: N, O, F).
A legalacsonyabb értékű változó meghatározása (a szabad elektronok száma). amelyek leggyakrabban nem fémek, a csoportszámot 8-ról kell levonni.
Az atom állapota, amelyben az előző alsórésztől az elektronpárból származó elektron "bomlik" és a következő alsó szintre megy, az atom gerjesztett állapotának nevezik.