Egy sok elektron atom, a kvantumszámok energiateljesítménye - a stadopedia
Kvantummechanikai számítások azt mutatják, hogy a multi-elektron atomok egy szinten változik energiájú elektronokat, elektronok töltse atomi pályák a különböző típusú és különböző energia. Minden energiaszint, kivéve az elsőt, olyan számú energiaszintre oszlik, hogy hány típusú pályát tartalmaz ez a szint. A második energiaszintre van osztva két alrétegből (2s és 2p sublevels), a harmadik energiaszint - három sublevels (3S, 3d-3R- és sublevels) stb felosztása a második, harmadik és negyedik energiaszintet ábrán látható ... 9.
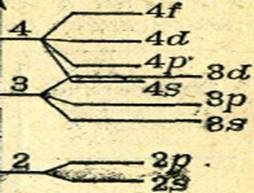
Mindegyik s-subweb tartalmaz egy s-AO-t, mindegyik p-alréteg három p-AO-val rendelkezik, mindegyik d-alrétegnek öt d-AO-ja van, és mindegyik f-alrétegéhez hét f-AO van.
Az energiaszintet az n fő kvantumszám jellemzi. Minden ismert elem esetében az n értékek 1-től 7-ig terjednek. A földben lévő többelektron atomjának (kimerítetlen) állapotú elektronjai az elsőtől a hetedikig tartják az energiaszinten.
Az energiaszintet az orbitális kvantumszám 1 jellemzi. Minden szinten (n = const) quantum szám l veszi az összes egész értékek 0 és (n - 1), például, ha n = 3 l értékek a 0, 1 és 2. A orbitális kvantum szám határozza meg a geometriai forma pályák.
Az atomok elektronikus héjainak kitöltésének szabályszerűségét az 1925-ben a svájci Pauli-féle fizikus (a Pauli-tilalom elve) által meghatározott tilalom határozza meg: két azonos állapotú elektron nem létezhet egy atomban egyidejűleg.
Két atom, amely különböző energiaszinteket és alsó szinteket foglal el egy atomban, különböző kvantummechanikai állapotokban vannak. Az egyik alsórész (n = const) különböző atomi pályáit elfoglaló elektronok különbsége, kivéve az s-subwooferet, mágneses kvantumszám ml. Ezt a számot mágnesesnek nevezzük, mivel az jellemzi az elektronok viselkedését egy külső mágneses mezőben. Ha az l értéke meghatározza az alvíz atomoszlopainak geometriai alakját, akkor a kvantumszám értéke határozza meg ezeknek a pályáknak a kölcsönös térbeli elrendezését.
Az adott alsávban mért mágneses kvantumszám az összes számértéket + 1-től -1-ig veszi, beleértve a nullát is. Az s-algebra esetében ml = 0.
A p-szubréteghez a ml három értéket tartalmazhat +1, 0, -1.
Így minden atomi orbitális egyedül három kvantumszámmal van meghatározva.
Három kvantumszám kombinációját egy adott atomi orbitálisra jellemzik, a kvantumszámok összes lehetséges értéke együtteséből.
Figyelembe véve azt a tényt, hogy mindegyik orbitális maximálisan feltölthető két elektronral, az egyes energiaszinten és alsó szintben elhelyezkedő elektronok száma kétszer akkora, mint az adott szinteken vagy alsó szinteken lévő pályák száma. Mivel az atomok egy atomos orbitálisban azonos kvantumszámmal rendelkeznek, n, l és ml. majd a két elektron megkülönböztetésére - egyetlen orbitálisan, a negyedik, spin kvantumszámot ms használják. amelyet az elektron spin határoz meg. A Pauli-elvnek megfelelően azzal érvelhetünk, hogy az atom minden egyes elektronját egyedülállóan négy kvantumszámú saját készlete jellemzi.
A populáció az energiaszintek, alsó szintek és atomok elektronjai által
Az orbitesek a következő szabályt betartják: egy kimerítetlen atomon minden elektronnak a legalacsonyabb energiája van.
Kitöltése atomi pályák belül az energia szintalatti zajlik összhangban szabály megfogalmazott német fizikus Hund F. (1927) (Hund szabály): atomi pályák egyazon alréteg, mindegyik első megtöltjük egy elektron, majd kitöltve a második az elektronok .