Iron Atom - Kémiai Kézikönyv 21
Kémia és vegyi technológia
Ezeknek az elemeknek az atomjai elektronikus szintjeinek szerkezetét az utolsó előtti szint alsó határának szinte teljes befejezése hat vasalattal, hét kobalt és nyolc nikkelben fejeződik be. Feltöltés - ezeknek az elemeknek az alsó szintje befolyásolja az oxidációs szám csökkenését. hiszen kevesebb párosítatlan elektron van a t-alsórésszel (lásd Chemistry Course, 1. rész, Általános elméleti, 11. fejezet, 86. oldal). Ezért, ha a mangánt még mindig +7 oxidálószám jellemzi. akkor a vasatom legfeljebb 6 elektront adhat, és ennek következtében oxidációs száma nem lehet + 6-nál nagyobb. A kobalt oxidatív száma nem lehet több, mint +5 és nikkel -1-4. Így. Ezeknek az elemeknek az atomjaiban már lehetetlenné válik, hogy minden nem teljesített szinteton elektron legyen valencia. A szinte teljes t-alvízet stabilitásának növekedésével párhuzamosan csökken az elemek hajlamosulása az elektronikus vezetőképességű fémszerű vegyületekre [C.126]

Ábra. 20-23. A citokróm c, amely egy globuláris fehérje, 104 aminosavval kapcsolódik egy lánchoz, és egy hemcsoportot. amely vasat tartalmaz. Ebben a vázlatos diagramban minden aminosavat feltételesen számozott,
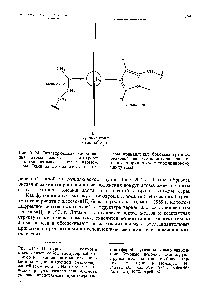
A vas-, kobalt- és nikkelatomok elektronikus szintjeinek struktúráját az utolsó előtti elektronikus szint, a hat elektron - vas, hét kobalt és nyolc-nikkel alsó szintje szinte teljesen befejezte. Feltöltés - ezeknek az elemeknek az alsó szintje befolyásolja az oxidációs szám csökkenését. mivel kevesebb alárendelt elektron van az alsó szintben. Ezért, ha a mangánt még mindig 4-7 oxidációs fok jellemzi, akkor a vasatom nem adhat tovább hat elektront, és ennek következtében oxidációs állapota nem lehet több, mint 4-6. A kobalt oxidatív száma legfeljebb 4-5 lehet, a nikkel pedig 4-4. a kitöltetlen szintek összes elektronja nem tekinthető ezen elemek atomjainak valens atomjainak. A szinte feltöltött alszint stabilitásának növekedésével párhuzamosan csökken ezeknek az elemeknek a tendenciája, hogy fémszerű vegyületeket képezzenek az elektromosan vezetőképességgel. Az ilyen típusú elektromos vezetőképességet csak ezeknek a fémeknek a szilidjei birtokolják. [C.297]
Hasonló hibridizáció történik az átmeneti elemekben. Ebben az esetben a 3d-, 4s- és 4 / -orbitokat kombináljuk. Különös érdeklődés a s / j d hibridizáció. Pauling azt mutatták, hogy míg a hat egyenértékű elektronikus szálak irányított, például mentén pozitív és negatív irányban a tengely x, y, z (oktaéderes hibridizáció). Ezeket a hibridizációkat a Fe (N) s vagy a Co (NH3) 6 ionok típusú komplex vegyületek szerkezetének magyarázatára használtuk fel. vas atom külső elektronok (3df (4s). Ion Fe + alatt definiált (3d) „(4s) amíg az energetikailag kedvezővé három gerjeszti egy elektront állapotból a W State 4P. Ezután hajtjuk állapotban (MU (4s) Az ezt követő ion ( 4P). Két / elektron, egy 4s és három 4p adnak oktaéderes hibridizáció. így hat erős kötések. kompenzáló fordított energia ua izgalom. [c.480]
Néha a környezetben bekövetkező kisebb változások súlyos változásokat okozhatnak a fehérje alakjában. amely hatással lesz a funkcióira. Például a vér pH-jának enyhe emelkedése megváltoztatja a hemoglobin molekulát úgy, hogy képes lesz átjutni a tüdő belső felületére, és egy vasatom nyílik a molekulában. Ennek eredményeképpen az oxigén könnyen összekapcsolható. Amikor a pH lecsökken, a lánc ismét összehajtogat, ami segíti az oxigén izolálását, miután áthelyezte a sejtbe, ahol szükséges. [C.455]
Az elektrolitokkal érintkezve a szerkezet (csővezeték) felületén található fématomok a vízmolekulák erőterének hatásának vannak kitéve. amely beágyazható a fémszerkezet kristályrácsába. Az erőhatás olyan erős lehet, hogy a fématomok kötődnek a kristályrácshoz. Az így felszabadult szerkezet fématomjai az elektrolitba jönnek, és a töltést hordozó iont alkotnak. A vízmolekulák, amelyek dipolek, az ion atom körül helyezkednek el. A vasatom a pozitív töltésű elektrolitba kerül. és a szerkezet negatív töltésű. Tehát van egy dupla elektromos réteg. amelyben a hidratált vasionokat a szerkezet felszínén tartják a szerkezet negatív töltéseivel való kölcsönhatás elektromos erőivel. Eljöhet egy olyan idő, amikor az elektromos erők hatására a kettős elektromos rétegben egyensúly alakul ki, és az acél atomjainak az elektrolitba történő további átmenete megszűnik. [C.6]
Hány gramm alumíniumot nyerünk vas-oxidból a) 5,6 g vas b) 4 g vas-atom [102.
Valence előrejelzése. Ha abból a feltételezésből indulunk ki, hogy egy atom valenciája megegyezik a külső héj páratlan elektronainak számával. akkor a nemesgázok atomjai nem adhatnak semmilyen vegyületet más atomokkal, mivel a földi állapotban az összes elektron pörgetése párosul. Eközben felfedezték és vizsgálták a halogénekkel és oxigénnel rendelkező nemesgázok vegyületeit, mint például Her. HeO 4, Xe 2, stb. Még nehezebb megmagyarázni az úgynevezett szendvics vegyületek létezését. például a ferrocén, ahol a vasatom a CdH két ciklikus molekulájához kapcsolódik. (17. ábra). Tíz szénatomot kell kötni, anélkül, hogy tíz elektron lenne a külső elektronhéjban. [C.57]
A króm és a vas aránya (százalékban) a ferrokrómban, amelyben minden három króm atom esetében van egy vas atom [c.162]
Az (1) és (2) egyenletek szerint az 1 g vasatornak 1,5 mól klórral és 1 g rézzel 1 mól klórral reagáltatunk. Ebben az esetben a klór mennyisége. Fe és Cu reagáltatásával a következő egyenletet fejezhetjük ki [c.450]
A vas atom tömegének kiszámítása grammban. 1 g-atom vas tömege 55,85, az atomok száma ebben a számban 6-10. Az 1 vasatom tömege = 55,85 g, 6-10 = 9,3 g. Hasonló problémák megoldhatók a következő módon: [c.7]
A szén-monoxid hidrogénezése, hogy alkoholt és szénhidrogéneket képezzen Gj a fent, viszonylag lassú katalitikus reakció. Anderson [27c] számította ki, hogy a szén-monoxid molekula a kobalt katalizátor felületén körülbelül 5 percen át él. mielőtt reagálna. Valamennyi aktív szintetikus katalizátor vas, nikkelt, kobaltot vagy ruténiumot tartalmaz fő hidrogénező komponensként. Ez a négy fém a szintézis körülményei között lassan, de mérhető mértékben fémek karboniljeiből áll, amelyek nyilvánvalóan meghatározóak. A nikkel és a kobalt optimális szintézis hőmérséklete 170-205 °, vas 200-325 ° és a ruténium 160-225 °. A nikkelkatalizátorok szintézisére megengedett maximális nyomás kb. 1 atm, kobalton - kb. 20 ° C. Magasabb nyomáson ezeknek a katalizátoroknak a hatása élesen csökken (ahogy a nyomás emelkedik). Vas-katalizátorok. a magnetit olvasztásával előállítva 20-100 ° C-on, míg a kicsapódott vas-katalizátorok 20 atm feletti hőmérsékleten gyengítik az I27d-t. A ruténiumkatalizátorok viszonylag inaktívak 100 atm alatti nyomás alatt, de aktivitásuk gyorsan növekszik, ahogyan 300-ra emelkedik [27e]. Optimális nyomás (O-1 atom Ni 1-20 atm Go, 1-20 atm Fe-kicsapott katalizátorok 20-100 atm Feldolgozott Fe-katalizátorok és 100-300 atm Lu) a nyomásarány (F szerelvényét az egyenlet sebessége = együttes xx nyomás ") körülbelül 0-0,5 a Ni és a Go esetében, és közel áll a Fe és Ru egységéhez [c.521]
Oxidok és gyroxidok. A vas formák oxigénnel a következő egyszerű FeO, FeOO és FeO3 oxidokat tartalmazzák. A FeO-oxid alapvető tulajdonságú. Pegos amfoter, FeO3 - savas. Az első két oxid képes kombinálni, hogy a Sourcane Oxide Pc3O4-ot képezze, amelyben az egyik vasatom az oxidációs állapotban + 2, a másik kettő pedig -S3-ra oxidálódik. [C.302]
Ehelyett narancssárga reakcióterméket izolálunk. a molekulában, amelybe a vasatom kiderült, az USA-val párhuzamosan egy vegyészcsoport ugyanazt a vegyületet kapta. Úgy döntöttek, hogy ez az anyag biszciklopentadienil-vas. [C.218]

Nagy jelentőséggel bír a vas komplexálása a bioligandumokkal [2, 114. o.]. 165-184]. Különösen fontos a hemoglobin, vas-tartalmú fehérje molekula. oxigénhordozó funkcióját az állatok és az emberek vérében végezzük. A hemoglobin fehérje globint és négy hemet tartalmaz. képviselő porfirin vas komplexet (II), ahol a vas-atom vegyértékkötést alkot a négy nitrogénatomot a porfirin-gyűrű, és egy kötést egy nitrogénatomhoz gistidina- aminosav, egy része b1elka globin. Hatodik helyen a koordinációs szférájában a vas (II) lehet elfoglalni molekuláris oxigénnel O2, és a CO-típusú ligandumok, CN és munkatársai. Ha belépett hemoglobin reagáltatjuk, például CO, elveszíti azt a képességét, hogy reverzibilisen csatolja O2. Ebben az esetben a szervezet meghal a hipoxia miatt. Ez megmagyarázza a CO, SC - és hasonló ligandok nagy toxicitását. [C.134]
Hány oxigén-oxid vas Fe P4 6 g-os vasat képez a levegőben való teljes égésükben. A válasz ezer mól és grammban kifejezve. [C.107]
VII.4., Ahol a 2. és 3. pont például megfelel a Fe (II) és Fe (III) oxidációs állapotainak. A Na2 komplex [Fe (N) 5NO], ábrán látható a 4. pont, attól függően, hogy a töltés tulajdonított nitrozo N0 pozitív, nulla (csoport semleges) vagy negatív vas atomot volna egy oxidáció mértéke (II), (III vagy IV. Alapján kémiai eltolódás e2rz / 2 (711,0 eV 710,0 eV ellentétben Ks [Fe (CN) e], és 708,7 a K4 [Fe (CN) b]), az oxidáció mértékét a vas a komplex ( IV). Ez azt jelzi, hogy a nitrozo-csoport töltése negatív. [C.159]
Jegyezzük meg a második sorban megjelenő 2 szorzót. A FeSj képlet szerint vas-atomonként 2 kénatom van, ezért rendszerünket Fe 2 -e-Fe-l [c.97]
Nagy osztálya komplexek komplexek Vitchev homok, amely egy őse ferrocén, ferrocén egy sárga-narancssárga kristályok a fémorganikus vegyület, amelyben a vas-atom található két nagymértékben szimmetrikus öttagú gyűrűk. (lásd a 13.7. reakcióvázlatot). [C.369]
Kommunikáció -ferrocén lehet tekinteni abból a szempontból az egyszerűsített molekulapálya elmélet [80]. Minden ciklopenta-dienil gyűrű öt három molekulapálya töltött kötés pályák és antibonding pályák a két üres (Sec. 2.9). A külső elektron héj a vas atom áll kilenc atomi pályák egy 45, három és öt 4R- Sc (d pályák. Hat elfoglalt pályák a két ciklopentadienil-gyűrűt átfedésben egy Z-, három és két p pályák a vas atom, amely tizenkét új pályák , amelyek közül hat kötődését és a forma két hármas kötést gyűrű fém. további kötési az eredménye átfedés betöltetlen antibonding pályák gyűrűk a többi lakott vas pályák. Ezért. kilenc pályák Rep 18 található elektronok (amely lehet tekinteni, mint 10 elektronok adni két gyűrűt, és a 8 -. Vasatomot a nulla oxidációs állapot) hat orbitális - erősen kötődő, és a három -. Gyenge kötődést vagy nem kötő [c.72]
A. A Mohr-féle sót (NH4) 2504-Fe304-6H20-t kapjuk. Számítsuk ki a 25% -os kénsav mennyiségét. 0,5 g vas feloldásához szükséges, és 1,5-szeres felesleget kell venni. Öntsük a vasport egy kémcsőbe, adjunk hozzá kénsavat és óvatosan melegítsük. Amikor a fém feloldódik. az oldatot szűrjük és porceláncsészében bepároljuk, amíg a kristályos kéreg a felszínen nem képződik. Melegen, telített ammónium-szulfát-oldatot készítünk, hogy vas-atomonként ammónium-szulfát molekulát kapjunk. Az így kapott oldatokat forró anyaggal keverjük, és 0 ° C-on hagyjuk kristályosodni. A kristályokat elválasztjuk a folyadéktól, és szûrõpapírral szûrjük. Mérjük meg a sót, és számítsuk ki a hozamot a vas százalékában. [C.398]
A csapadékot leszűrjük, hideg vízzel mossuk és szárítjuk, majd 40-50 ° C Geksabeizo-atom vas (III) -P Flint színű, levegőn stabil, vízben oldhatatlan, oldódik acetonban, amelyek arra perekristallnzovat, [c.264 ]
Ferrocén, az első metallocén szintetizált 1951-ben Georgia (Kim és Pawson) már sandvicheobraznoe szerkezete - két párhuzamos ciklopentadienil gyűrű atom vas, és a molekula egy központja szimmetria (XVI). Ezt követően, az egyéb metallocéneket típusú XVI, amelyekben a vas-atom kaptuk helyettesítettük Ti atomok, V, Cr, Mn, Co, N1, Ri, Oz, Mg. [C.307]
Ha a vasatomok száma nagyobb, mint egy. egy klaszter (raj) alakul ki, amelyben feltételezhetően létezik egy elektron-kötés a vas-atomok között. A klaszter a cisz-stein mellett szintén labilis ként tartalmaz, és el tudja fogadni, hogy egy elektronhoz jusson. Az 1Pe-5 típusú fehérje, azaz amely egy vasat tartalmaz, nevezetesen a rubredoxint, különféle módokon alaposan tanulmányozták. Ennek eredményeképpen bebizonyosodott, hogy a fehérjemolekula egyetlen vasatomját négy ciszteinmaradék veszi körül, amelyek a tetraéder tetején találhatók. Mindkét (oxidált és redukált) állapot a nagy spin. Ezek a fehérjék molekulatömege körülbelül 6000, és egy elektront egy molekulához továbbíthatnak. [C.366]
Lásd azokat az oldalakat, ahol a "Vas Atom" szó szerepel. [c.219] [c.121] [c.192] [c.367] [c.219] [c.16] [c.15] [c.150] Művek Népszerű nem-fikciós, történeti, kritikus bibliográfiai és egyéb kémiai munkák 3. kötet (1958) - [c.229]