Az erythropoiesis mechanizmusa és szabályozása
Az erythropoiesis mechanizmusa és szabályozása
Az erythropoiesis szabályozásában döntő szerepet játszik az eritropoietin, amelynek hiányában a PFU-E nem szaporodik, vagy nagyon lassan oszlik el. A hemoglobin szintézise az erythroblasztokban szintén gátolt. Nyilvánvaló, hogy az erythropoiesis intenzitása az eritropoietin szintjétől függ. A citokin fő termelési helye a vesék, itt termelését az oxigén feszültség szabályozza. Minden esetben, amikor a pO2 csökken (vérveszteség, magassághoz, tüdőbetegséghez stb.), Eritropoézis stimulálódik.
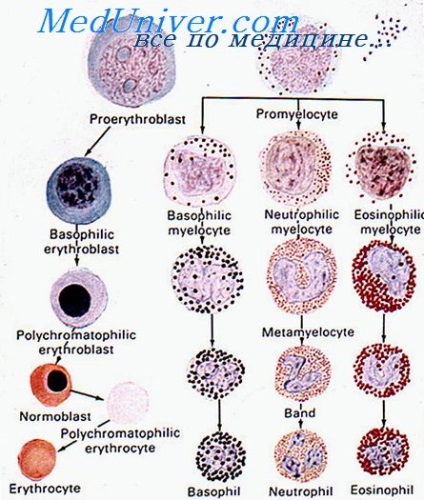
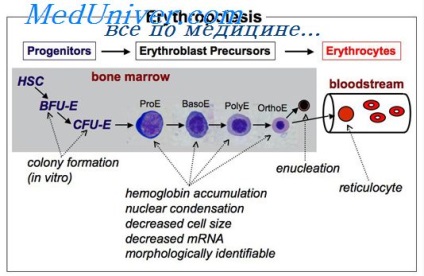
Amikor vesebetegség gyakran alakulnak vérszegénység miatt csökkenése / megszűnése eritropoietin termelés, amely megerősíti a jelzett terápiás hatása ebben patológia. Erythropoiesis végül jelentése egy többlépéses folyamat differenciálódását BFU-E és CFU-E-stádiumba morfológiailag felismerhető a korai és késői erythroblastok és retikulociták érett eritrociták. E folyamat során, az egymást követő kialakulását proerythroblast, bazofil, polychromatophilic eritroblasztok és oxyphilic pozitívan szabályozza az eritropoietin.
Az eritroid differenciálódás különböző stádiumaiban az eritropoietin hatása változik: a proterthroblasztok az apoptózis megnövekedett proliferációjával, érlelésével és megelőzésével reagálnak rá. Az anti-apoptotikus gének expressziója nagyon alacsony, és az éretlen eritroblasztok szinte teljesen érzékenyek az eljárás induktoraira, eritropoietin hiányában. Ez utóbbi elnyomja az apoptózist a Bcl-XL gén expressziójának indukálásával, amely a Bcl-2 család tagja, amely a programozott sejthalál elleni védelemben vesz részt.
A Bcl-XL expressziója nagyon alacsony a korai eritroid-differenciálódás és a közép- és a késői erythroblasztok növekedése között, az eritropoietin függőség elvesztésével párhuzamosan. Így az eritropoetin szintje meghatározza az eritroid differenciálódás sejtjeinek sorát a korai erythroblasztok túlélésének fenntartásával.
A csontvelőben erythropoiesis fordul elő konkrét anatómiai egységek - erythroblast szigetecskék, amely egy vagy két, etetők makrofágok körül egy vagy több gyűrű különböző eritroblasztból érési szakaszaiban. A belső réteg a eritroblasztok gyűrű tartalmaz éretlen sejtek és érettebb a periférián a sziget. A térbeli eloszlása érett és éretlen erythroblastok játszhat fontos szerepet eritropoiézisre a sejt-sejt kölcsönhatások szükségesek a normális működéséhez erythrone.
Az érlelő eritroblasztok gátlójelet továbbíthatnak a szomszédok számára, mivel érésük csökkenti a szervezetnek az eritroid sejtek iránti igényét. Az erythroblasztok Fas (egy olyan receptor, amelynek aktiválódása apoptózist indukál) fokozza az eritropoietin szintjének csökkenését. Érdekes, hogy a Fas-indukálta apoptózis megakadályozásához szükséges eritropoietin-koncentráció hasonló az alacsony hemoglobinnal vagy csökkent vörösvérsejt-vérben szenvedő betegek vérszérumához.
A Fas expressziója, mivel a korai erythroblasztok érik a fokozódást, és magas marad a terminális differenciálás szakaszában. A Fas-kötés csak kevésbé érett eritroblasztokban hatásos, szinte a basophil szintjén, ha apoptózis indukcióra van szükség az eritropoietin magas szintjének ellensúlyozására. Ezzel szemben a Fas-ligandum szelektíven expresszálódik késői differenciált Fas-érzékeny eritroblasztokban, főként az oxifil fázisban. A Fas-ligandum funkcionális érett eritroblasztokban, és Fas-érzékeny eritroblaszt-célok Fas-függő apoptózissal járó halálát okozhatja. Fontos, hogy a Fas-ligandumot hordozó érett eritroblasztok éretlen erythroblasztok Fas-függő sejtvesztését okozzák. A nagy dózisú eritropoetin ezt a hatást megszünteti. Ez a negatív visszacsatolás jelenlétét jelzi az erythroblaszt szigeten.
Az érett, de nem terminálisan differenciált sejtek citotoxikus hatást fejtenek ki közvetlen elődeikre. Hipotetikusan ez a negatív szabályozás az alacsony eritropoetin szinthez kötődik. Az eritropoézis stimulálásakor gátolható a termelés növelése. A Fas és a Fas ligandumok kölcsönhatása mechanizmust jelenthet az eritropoézis apoptózis által közvetített irányítására.
Fontos megjegyezni, hogy a szabályozása eritroid differenciálódást, a számos újonnan kialakult érett sejtek (eritrociták) nem kritikus az eritropoézist intenzitása: még súlyos polycythaemia erythropoiesis felerősödött dózis-függő módon az exogén eritropoietin. A hatás meglehetősen független a mértéke polycytaemia száma és a vörösvérsejtek forgalomban. A szabályozás döntően a fiziológiai funkciója az érett sejtek - oxigént szállító, feszültsége a vesékben.