Oktatási portál
Gázmolekulák mozog a különböző sebességek, mind a nagysága és iránya a sebesség az egyes molekulák folyamatosan változik összeütközés következtében (mint később látni fogjuk, normál körülmények között, minden molekula megy át a második körülbelül 10 szeptember ütközések).
Mivel a mozgás minden iránya egyaránt valószínű, a molekulák eloszlása az irányok mentén egységes lesz: bármilyen irányított, de állandó szögben, minden időpontban az azonos számú molekula átlagos mozgásának iránya
A helyzet eltér a molekuláris sebesség numerikus értékeitől. Lehetséges értékek. amelyek a nullától a végtelenig határoznak, egyáltalán nem valószínűek. Ez a következő megfontolásokból következik: a molekulák sebessége ütközéskor változik véletlenszerűen. Előfordulhat, hogy egy sor egymás utáni ütközés során egy molekula az ütközés során partnereitől energiát kap, aminek következtében energiája jelentősen meghaladja az átlagos értéket. Azonban, ha azt képzeljük, mint egy fantasztikus esemény, amelyben az összes molekula gázt megáll, át az energiát egyetlen molekula, majd az energia a molekula, és ebből következően a sebessége véges. Így a gázmolekulák sebességének általában nem lehet értékei, kezdve valamivel akár. Tekintettel arra, hogy a folyamat vezetne összpontosító egyetlen molekula jelentős hányada a teljes energia az összes molekulák, nem valószínű, azt lehet mondani, hogy túl nagy, mint az átlagos érték a sebesség valósítható nagyon ritkán. Hasonlóképpen gyakorlatilag lehetetlen, hogy az ütközések következtében a molekula sebessége pontosan nulla lesz. Következésképpen a sebesség átlagos értékéhez képest nagyon kicsi és nagyon nagy, és ez a valószínűsége nem valószínű # 965; nullához hasonlóan. így és mikor.
A fentiekből következik, hogy a molekulák sebességét leginkább egy legvalószínűbb érték közelében csoportosítják.
Annak tisztázása, hogy milyen módon lehet kvantitatív módon leírni a molekulák eloszlását az értékekkel # 965; a következő vizuális technikát használjuk. Feljegyezzük a sebességek értékét a tengelyek pontjai szerint # 965; Ezután minden tengelyen lévő molekulának egy olyan pontot kell megadnia, amelynek a kiindulási ponttól vett 0. ponttól való távolsága numerikusan megegyezik az adott molekula sebességének nagyságával (236. ábra)
Tegyük fel, hogy van módunk egy bizonyos mennyiségű gáz N-molekuláinak sebességének egyidejű meghatározására. Miután a kapott eredményeket a tengelyen lévő [1] pontok formájában készítettük # 965; a molekuláris sebességek "pillanatképét" kapjuk egy bizonyos ideig t (237. ábra). Ha az összes értéket # 965;
ugyanúgy valószínűek voltak, hogy a pontok a tengely mentén oszlanak el # 965; egyenletesen. Azonban, ahogy fent láttuk, a sebességeket leginkább egy bizonyos legvalószínűbb érték közelében csoportosítjuk. Közel a nulla és a nagyon nagy sebességértékek viszonylag ritkák. Ezért a pontok elosztása a tengelyen # 965; egyenetlen lesz, sűrűsége különböző a tengely különböző szakaszain.
Miután meghatároztuk a pontok sűrűségét a pontok számának arányában. az intervallum határain belül (237. ábra), az intervallum nagyságrendjéhez:
azt mondhatjuk, hogy ez a mennyiség egy függvény. Valójában annak értéke attól függ, hogy hol van a tengely # 965; egy intervallumot veszünk, azaz a # 965;
Minden két molekula közötti ütközési cselekmény véletlenszerűen megváltoztatja a tengelyen lévő megfelelő pontok helyzetét # 965; Ezért, ha több "fényképet" hasonlítunk össze különböző időpontokban: t1. t2, stb. (238. ábra), akkor általában ezeken a "fényképeken" nincsenek egymásnak megfelelő pontok. Ha azonban a gáz egyensúlyi állapotban van (azaz változatlan paraméterekkel rendelkező állapotban), akkor a molekulák sebességeloszlása változatlan marad. Ezért a sűrűség, amellyel a pontok a tengely különböző részeiben vannak elosztva # 965; minden alkalommal ugyanaz lesz.
Ha ugyanolyan feltételek mellett (azonos p és T esetén) több gázt veszünk be, akkor
a molekuláris sebességeloszlás is azonos lesz. Ugyanakkor a pontok sűrűsége a tengelyen # 965; a tengely mentén eloszlásukkal azonos jelleggel, nyilvánvalóan arányos az N molekulák számozott számával, és következésképpen a gáz különböző részei eltérőek lesznek. Ugyanaz a különböző részek az arány lesz
megadja annak a valószínűségét, hogy a molekula sebességének értéke a megadott értéken belül van # 965; i) a sebességtartományt (# 965, amikor a [2] intervallum indexeként szolgál.
átvette az összes intervallumot. amelyen meg lehet szakítani a tengelyt # 965; nyilvánvalóan meg kell egyeznie az N molekulák teljes számával, ami az elosztási függvény következő tulajdonságát jelenti;
Az utolsó eredmény a következőképpen magyarázható. kifejezés
Az a valószínűség, hogy egy molekula sebessége 0-tól 0-ig terjedő tartományba esik. Mivel a molekula sebességének szükségszerűen van valamilyen értéke, ez a valószínűség egy megbízható esemény valószínűsége, és ezért egyenlő egyvel. Szigorúan a feltétel (106.4) a következőképpen kell megfogalmazódni:
ahol A egy olyan tényező, amely nem függ # 965; m a molekula tömege, k a Boltzmann konstans.
A Maxwell eloszlásfüggvény jellemzője az a körülmény, hogy az exponensben e, a molekula kinetikus energiájának aránya a figyelembe vett sebességgel a "-" # 965; a kT-hez. azaz egy olyan mennyiséget, amely a molekula átlagos energiáját jellemzi.
Mivel a faj tényezője növekszik # 965; gyorsabban csökken, mint a szorzó, a függvény, kezdve a nullától (miatt), eléri a maximális értéket, majd aszimptotikusan nullára tolódik
A (106.5) feltétel lehetővé teszi számunkra, hogy kiszámítsuk az A tényezőt (106.6):
Ezt a feltételt a függvény normalizációs feltételeinek nevezik, és az A-t normalizációs faktornak nevezik.
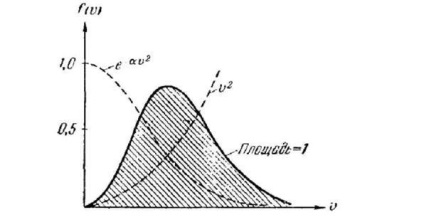
A számítások az A értéket adják. Így a Maxwell eloszlásfüggvénynek van az alakja
Amint várható, a funkció specifikus formája függ a gáz típusától (a molekula tömegétől) és az állapot paraméteren (a T hőmérsékleten). Megjegyezzük, hogy a gáz nyomása és térfogata nem befolyásolja a molekulák sebességeloszlását.
Úgy tűnhet, hogy a függvény (106.7) helytelenül írja le az eloszlást azzal a ténnyel kapcsolatban, hogy csak a végtelenben eltűnik, miközben a sebesség realizálható értékeit véges határ korlátozza. Azonban elég nagy méretű # 965; a funkció (106.7) annyira különbözik a nullától, hogy a jelzett eltérésnek gyakorlatilag nincs jelentősége. Az elosztási funkció maximális értékének megfelelő sebesség valószínűleg a legvalószínűbb. Valójában, ha összehasonlítjuk azoknak a molekuláknak a számát, amelyek sebessége különböző módon választott, de egyenlő intervallumintervallumokban, akkor a legnagyobb lesz a megfelelő távolság, amely a maximális közelségben van. Így, a legnagyobb találati probléma megoldásával, a legvalószínűbb sebességet találjuk. Differenciálás (106,6) # 965; és a kapott kifejezés nullává alakul, akkor:
Az egyenletnek megfelelő értékek megfelelnek a minimumoknak. érték # 965; a zárójelben lévő eltűnő kifejezés az, amelyet keresel:
Az intervallum óta # 8710; vi kicsi, mindegyik sebesség A Nvi molekulákat megközelítőleg egyenlőnek kell tekinteni az intervallumhoz tartozó sebességekével # 8710; Ezután az összes N molekulák sebességének összegét ábrázolhatjuk. Ez az összeg az N molekulák számával osztva [figyelembe véve (106.10)] az átlagsebesség kifejezését:
Átkerülve az összegből az integrálissá, ezt találjuk
Ez az eredmény megegyezik a korábban kapott (99.11) kifejezéssel. Ahhoz, hogy ezt láthassuk, helyettesíteni kell y-t (99.11).
Meg kell jegyezni, hogy és.
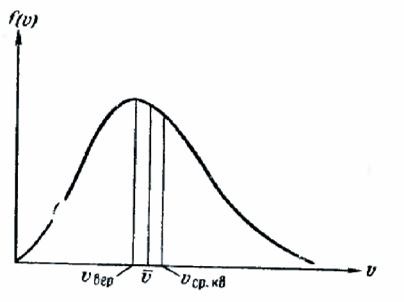
Összehasonlítva a (106.8), (106.12) és (106.13) összehasonlítást, látható. és ugyanúgy függ a molekula hőmérsékletétől és tömegétől, amely csak számszerű tényezőtől függ. Ha 1, akkor = 1,13, = 1,22 (241 ábra).
Újra hangsúlyozni kell, hogy a molekuláknak a sebességre és az azokból következő következményeire vonatkozó Maxwell-törvénye csak egyensúlyi állapotban lévő gázra érvényes. A törvény bármely N számra érvényes, ha csak ez a szám elég nagy. Maxwell törvénye statisztikailag pontosabb, és a statisztikai törvények pontosabbak, annál több azonos objektumra alkalmazzák őket. Kis számú objektum esetén jelentős eltérések lehetnek a statisztikák előrejelzésétől.
Ha egyensúlyi gázok keveréke van, akkor az egyes fajták molekuláihoz tartozó eloszlás (106.7) értéke m. A nehezebb molekulák átlagosan kevesebb sebességgel mozognak, mint a könnyebbek.
A molekulák sebességeloszlása alapján
megtaláljuk a molekulák eloszlását a transzlációs mozgás kinetikus energiájának megfelelően. Ehhez menjen a változó v-ről a változóra # 949; egyenlő az mv 2/2-vel. A helyettesítést u (106.14). kapunk
Az oxigén molekulatömege 32. Következésképpen egy kilométeres tömeg # 956; = 32 kg / kmol. A szobahőmérséklet kb. 300 ° K. A numerikus képletben (106.17) a számlálóban lévő mennyiségek numerikus értékének helyére a következőket kapjuk:
Így minden egyes oxigénmolekula másodpercenként egy 0,5 km-es átlagnak felel meg. Mivel a molekula nagyon gyakori ütközéseket mutat más molekulákkal, ez az útvonal nagyszámú rövid, egyenes vonalú szegmensből áll, amely egy törött vonalat képez.
Hidrogén molekulák tömege 16-szor kisebb, mint az oxigén molekula, úgy, hogy a sebességet a fenti hőmérsékleten 4-szer nagyobb, és lesz szobahőmérsékleten I átlag körülbelül 2 km / sec.
[1] Ne feledje, hogy minden ponton csak egy másodpercet tölt, 1012 évnek kell dolgoznia rajzpontokon.
[2] A valószínűsége, hogy egy molekula sebességének önkényesen meghatározott értéke van # 965; egyenlő nullával. Ez azért van, mert a lehetséges értékek száma # 965; de az N molekulák száma legalább nagy, de természetesen (hasonlít a 100. §-hoz, a (100.1) -tól (100.2) -ig).