Cheat lapok a kémia
A sók hidrolízise reverzibilis folyamat. Számára, mint bármely más reverzibilis reakcióhoz, az egyensúlyi állapot jellemző, amely a Le Chatelier elv szerint elmozdítható. Például, ha savanyítjuk az NH 4Cl só oldatot, akkor az egyensúly balra tolódik, vagyis a hidrolízis lelassul:
Amikor az oldatot hígítjuk, az egyensúly jobbra tolódik, vagyis a só hidrolízise fokozódik.
Ha a sót egy gyenge oldhatatlan (vagy illékony) bázissal és egy gyenge illékony (vagy oldhatatlan) savval képezik, akkor egy ilyen só hidrolízise a végéig megy végbe. Például az oldatban lévő Fe 2 (CO 3) 3 nem létezik, mivel teljesen hidrolizál:
Az eredményben a Fe (OH) 3 barna csapadék kicsapódik, és a CO2 gáz felszabadul.
A sók kationos hidrolízisének oka a víz disszociációja egyensúlyának elmozdítása a sók kationok hatására a hidrogén kationok felhalmozódása felé.
Az anion feletti sók hidrolízisének oka a vízsavas anionok hatásának a víz disszociációja egyensúlyának elmozdulása az OH - anionok felhalmozódása felé.
A sók kationos és anionos hidrolízisének oka.
Mivel a sót gyenge bázis és gyenge sav képezi, a kationok és a só anionok bomlik a víz:
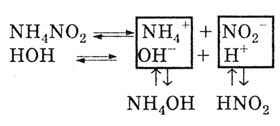
Ennek eredményeként a közeg reakciója semleges, gyengén savas vagy gyengén lúgos. Ez a gyenge savak és bázisok disszociációjának mértékétől függ.
A feladat. Írja le a hidrolízis reakciók egyenletét:
- a) ammónium-klorid;
- b) nátrium-acetát molekuláris és redukált ionos formában.
Adja meg a környezet reakcióját. Hogyan változik a lakmus színe ezeknek a sóknak a megoldásaiban?
Oldat, a) ammónium-klorid NH4CI - az ammónium-klorid NH4OH gyenge bázisával és erős savas sósavval képzett sóját a kation hidrolizálja. A csökkentett ionos egyenlet:
Egy molekuláris egyenlet megírásához olyan ionokat adjon hozzá, amelyek nem vettek részt a hidrolízisben, de oldatban vannak. Ezek a kloridionok:
A közeg reakciója savas. A litmus pirosra fordul.
b) Nátrium-acetát CH3COONa - a nátrium-hidroxid erős bázisa és a gyenge sav CH3COOH által képzett só hidrolizálódik az aniontal. Ezt a folyamatot csökkentett ionos egyenlettel fejezhetjük ki:
A hiányzó Na + kationok hozzáadása a molekuláris egyenletet adja:
A reakció lúgos, a lakmus kék.