A vegyületek termodinamikai stabilitásának értékelése
Egy adott vegyület termodinamikus stabilitását a Gibbs energy AG változása határozza meg, amikor bizonyos fizikai körülmények között képződik (p, T). Ennek a vegyületnek a bomlása megköveteli az ugyanazon energia költségét, és ezáltal meghatározzák a kohászati eljárás képességeit.
A magas hőmérsékleti tartományban az elemi oxidáló szerekkel (O, S, N, H) fémvegyületek bomlanak le, és felszabadítják az oxidálószert a gázfázisba, például:
2FeOt * = ± 2Fetv - 02gas f •
A fém és az oxidálószer közötti reakcióegyenleteket célszerűen bomlási reakcióként írják le, meghatározva az egyenlet koefficienseit oly módon, hogy bal oldali gázmolekula keletkezik, például:
Ebben az esetben a Gibbs energy AG0 standard változata az összes reakció általános egyenletében fog megjelenni.
AG ° = AH-TAs = - RTnN02, (9.1)
és mivel az egyensúlyi konstansok meghatározására szolgáló kifejezések azonosak, azok kényelmesen összehasonlíthatók egymással a vegyületek közötti kölcsönhatás irányának meghatározásában a co-in kohászati folyamatok között. Egy heterogén rendszer, amelyben
Ez az egyensúly létezik (9.1. Ábra), egyfajta szabadsággal rendelkezik: C = 2 + 2 - 3 = 1,
p02 = MP vagy T = / Ap02). (9.2)
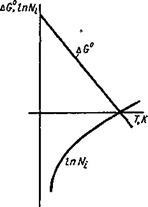
Az AG függése bizonyos határértékeken (fázisátalakítások nélkül) lineárisan változik, és az oxigénnyomás logaritmusa a görbe mentén változik, amint az az 1. ábrán látható. 9.2. A hőmérsékleti tengely kereszteződési pontja megfelel a következő feltételnek:
AG ° = 0; lgA ^ O2 = 0 vagy Nuc = 1. (9.3)
A fizikai jelentés az, hogy T0 hőmérsékleten az oxigén feletti egyensúlyi oxigén nyomás egyenlő a tiszta oxigén külső nyomásával, vagyis a tiszta oxigénben a fém nem oxidálódik. Az aktív fémek esetében ez a hőmérséklet nagyon magas és a fém forráspontja fölött van, és a kevésbé aktív fémek, mint például a réz, alacsonyabb hőmérsékleten teljesítik ezt a körülményt.
A Gibbs energy AG0 standard változatának egyszerűsített egyenletét (lásd a 8.3. Pontot) az alábbi egyenleteket kapjuk az oxidok disszociációjához:
2. Cu20 ^ 4Cu + 02; AG £ U20 = 334 720 - 150,37 T
2Fe + 02; ДСре0 = 527 360 - 114,75 Т;
9. ábra 1 A fém oxigénnel való kölcsönhatásának rendszere
2MnO ^ 2Mn + 02; A0 ^ nO = 769-860-148,05 T; SiCWSi + 02; AGsi02 = 1 718 600-181,66 G; 2 / 3A12Oa ** 4 / 3A1 + 02; AG £, = 1 116600 - 209,11 T.
9. ábra 2. A DS ° függése és a fémoxid disszociációs nyomásának hőmérsékleti logaritmusa
Ábra. 9 3 A DS ° változása a fémhőmérséklet AbO3, S1O2 függvényében, fémoxidok redukciója MnO-ban, FeO, CU2O T = const
Az 1. ábrán. 9 3 az AG ° => (T) függvény grafikonjai. Az oxidok termodinamikai stabilitása növekszik a Cu-> Fe - * - Mn - * Si - * - Al elemek sorában, de a 2500-as hőmérsékleti tartományban. 3000 K az Mn és Si oxidok stabilitása helyeken változik. A hőmérséklet, amelynél a termodinamikus stabilitás eltűnik, a következő: Tcuo = 2230 K; 7Veo = 4600 K; 7'mo = 5200 K; Ts, 02 = 4730 K; GAI2o3 = 5330 K (ez egy közelítő adat, amelyet nagyon közelítő számítással kaptunk).
A termodinamikai stabilitás jelentősen változik a környezeti gáznemű reakciótermék parciális nyomásától függően.
Ha vas-oxid esetében 4600 K AGpe0 = 0 hőmérsékleten p = 1 011-105 Pa nyomáson, akkor P = 1,33 X X 10
2 Pa (10-4 mm Hg) A До0 nulla lesz a hőmérsékleten
A vegyületek különböző termodinamikai stabilitása, például az oxidok lehetővé teszik közöttük oxidációs-redukciós reakciókat.
Két izolált hajót veszünk T = const-en (9.4 ábra). Az egyikben van egy 2AO * = ± 2A + Cbf rendszer, a másik pedig 2BO = f ± 2B + 02f. Tegyük fel, hogy az AGA0> AGg0 és az egyensúlyi oxigénnyomás p ^<р'о2. Если сосуды соединить между собой, то кислород будет переходить от оксида ВО к металлу Айв результате получим восстановление металла В в результате окисления А:
Ezt a folyamatot metallotermnek nevezik.
Hasonlóképpen oxidok disszociáció fontolóra PROTSES-sy disszociációs szulfidok, nitridek, és fém-hidridek, az ugyanolyan mértékben fogja meghatározni a termodinamikai felfekvési-séget. Az együtt elemi oxidálószerek (O, S, N, H, halogének) elemek változó mértékű oxidációt és disszociációja a vegyületek fordulnak elő chato-szakaszok a legmagasabb alacsonyabb oxidációs állapotban, például a:
4 / 3Cr03 ^ 2 / 3Cr20s + 02f; 2Cr2035 = t 4Cr0 + 02f; 2CyO2Cr +
2FeS2 ^ 2FeS + S2f; 2FeS ^ 2Fe + S2f;
SF6 ^ SF4 + F2f; SF4 ^ SF2 + F2t, és így tovább.
A vegyületek termodinamikus stabilitása erősen megnő, ha ezek a vegyületek oldatokban vannak.