Személyes oldal - lecture05
Tápanyag
A környezetre vonatkozó követelmények
- legyen tápláló; könnyen emészthető formában tartalmazzák az élelmiszerek és energiaigények kielégítéséhez szükséges összes anyagot. Számos mikroorganizmus kultiválásakor növekedési faktorokat vezetnek be a táptalajba - olyan vitaminokba, amelyekben a sejt nem tud szintetizálni.
- az optimális koncentráció a hidrogén-ionok - pH, mert csak a héj áteresztőképességét befolyásoló tápközeg optimális reakciójánál a mikroorganizmusok elnyelik a tápanyagokat.
A legtöbb patogén baktérium esetében az enyhén lúgos közeg optimális (pH 7,2-7,4). Kivételt képez a kolera vibrio - optimális a lúgos zónában (pH = 8,5-9,0) és a tuberkulózis kórokozója, amely gyengén savas reakciót (6,2-6,8 pH) igényel.
Ahhoz, hogy a mikroorganizmusok növekedése során a létfontosságú aktivitásuk savas vagy lúgos termékei ne változtassák meg a pH-értéket, a tápközegnek pufferelnie kell. azaz olyan anyagokat tartalmaznak, amelyek semlegesítik az anyagcserét.
- izotóniás legyen mikrobiális sejtek számára; azaz Az ozmotikus nyomásnak a tápközegben azonosnak kell lennie a sejt belsejében. A legtöbb mikroorganizmus esetében az optimális közeg 0,5% -os nátrium-klorid-oldatnak felel meg.
- legyen steril, mert az idegen mikrobák megzavarják a vizsgált mikroba növekedését, meghatározzák annak tulajdonságait és megváltoztatják a táptalaj tulajdonságait.
- A sűrű közegnek nedvesnek kell lennie, és optimális konzisztenciát kell biztosítani a mikroorganizmusoknak.
- van egy bizonyos oxidációs redukciós potenciálja, azaz az elektronok adását és fogadását végző anyagok RH2 indexben kifejezett arányát. Például az anaerobok az RH2-ben reprodukálódnak. legfeljebb 5 és aerob - az RH2 nem lehet alacsonyabb 10-nél.
- legyen a lehető legegyenletesebb, pl. állandó összetevőket tartalmaznak.
Kívánatos, hogy a média átlátható legyen - célszerűbb a kultúrák növekedését követni, a külföldi mikroorganizmusok környezetének szennyeződését könnyebb megfigyelni.

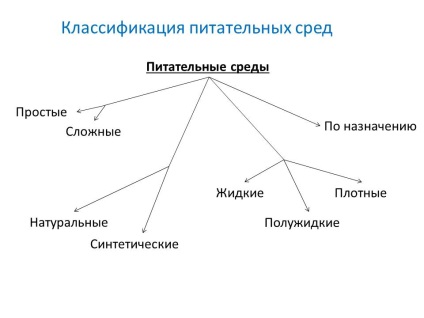
- Forráselemek:
- természetes környezetben - állati és növényi eredetű termékekből készülnek (hús, csont- és halliszt, takarmányélesztő, vérrögök stb.)
- szintetikus táptalajt - bizonyos kémiailag tiszta szerves és szervetlen vegyületekből állítanak elő, pontosan meghatározott koncentrációkban és kétszer desztillált vízben feloldva.
- Konzisztencia (sűrűség mértéke):
- folyadék
- semi
- vastag
Sűrű és félig folyékony közegeket állítanak elő folyadékból, amelyhez agar-agart vagy zselatint adnak. Ezenkívül sűrű táptalajként zsugorított vérszérumot, összehajtott tojásokat, burgonyát, közepes mennyiségű szilikagélt használtak, néhány mikroorganizmus táplálékként zselatint használ - növekedésüknél a tápfolyadék cseppfolyósított.
- Összetétel szerint:
- egyszerű: hús-pepton húsleves (MBP), hús-pepton agar (MPA). tápláló zselatin,
- komplex - készítsen hozzá egyszerű média vér, szérum, szénhidrátok és egyéb anyagok.
- Megbízás szerint:
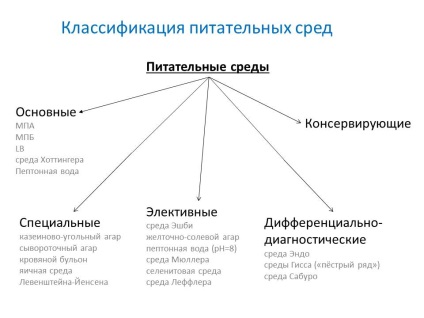
- alap - szolgál a legtöbb patogén mikrobák termesztésére. MPB, MPA, húsleves és Hottingera agar, peptonvíz.
- Speciális - olyan mikroorganizmusok izolálására és növekedésére szolgálnak, amelyek nem növekednek egyszerű médiumokon.
- választható (lekérdezés) - arra szolgálnak, hogy konkrét fajokat izolálni a mikrobák, amelyek előnyben részesítik a növekedési, késleltetésére vagy gátlására a mikroorganizmusok szaporodását kapcsolatos. A környezetek válnak választékossá, ha bizonyos antibiotikumokat, sókat, pH-értékeket változtatnak hozzá. A folyékony elektív adathordozókat akkumulációs médiának nevezik.
- differenciáldiagnosztikai - lehetővé teszik, hogy enzimatikus aktivitással megkülönböztessük a mikrobák egy típusát a másikiktól.
- Tartósítószer - elsődleges vetéshez és a vizsgált anyag szállításához.
- Hús-pepton húsleves (MPB) - folyékony közeg
- A hús-pepton agar (MPA) sűrű táptalaj
különleges
A speciális módszereket specifikus komponens hozzáadásával vagy a szubsztrátum helyettesítése jellemzi.
- kazein-szén agar
- szérum agar
- vérhígító
- a Levenstein-Jensen tojás környezetben
választási
A választási módszereket csak az érdekes mikroorganizmus növekedése jellemzi.
- Ashby környezet - nitrogén rögzítőkhöz
- sárgás só-só agar (HSA) - a staphylococcus aureus esetében
- peptonvíz (1%, pH = 8) - a kolera vibrio esetében
- Muller közege a szalmonella számára
- szelenit táptalaj - a szalmonella esetében
- Leffler-tápközeg - hatékony a corynebaktérium diftéria kezelésére
Differenciáldiagnosztika
Engedélyezze az egyedi bakteriális típusok, fajok és csoportok azonosítását.
- a Giss környezete (a "motley sorozat")
- Endomo - a virulens enterobaktériumok meghatározása
- Szerda Saburo - antibiotikum hozzáadásával
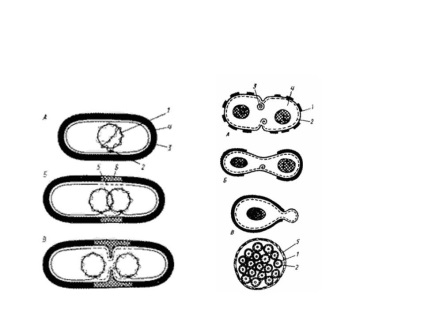

Szinkron kultúrák
A szinkron tenyészetek olyan bakteriális kultúrák vagy populációk, amelyekben minden sejt a sejtciklus azonos szakaszában van. A természeti kultúrákban - időszakos és folyó - ez a jelenség nem figyelhető meg. Még a növekedés exponenciális fázisában is a kultúrák nem osztódó sejteket tartalmaznak, amelyek a szétválás különböző szakaszaiban vannak. A szinkronsejtosztást mesterségesen indukálják, befolyásolva a tenyésztést különböző tényezők, például csökkentett vagy emelt hőmérsékleten. Úgy véljük, hogy a kedvezőtlen hõmérsékletek befolyásolják az osztódó sejtek fejlõdését, amelyek érzékenyebbek a különbözõ tényezõk hatásaira. Ennek eredményeképpen a fejlődés lelassul. Ez alatt az idő alatt más kultúrasejteket is felkészítenek a felosztásra. Az optimális hőmérséklet következő hatása fokozatosan szinkronsejtosztást eredményez. Szinkron tenyészetek előállításához a kényszerített éhezés módszerét alkalmazzuk. A sejteket egy hibás táptalajra helyezzük, tenyésztjük, majd telítettvé tesszük. A fotoszintetikus baktériumokban a szinkron tenyészeteket könnyű és sötét termesztési módok váltakozásával állítják elő. Mechanikai módszereket is alkalmaznak: a speciális szűrőkön keresztül történő tenyésztés (azonos méretű sejtek kiválasztása) és centrifugálás (a hasadási ciklus elején a sejtek kisebbek és lassabban ülepednek).
A szinkron tenyészeteket használják az egyes sejtösszetevők szintézisének tanulmányozására a sejtosztódás folyamatában.
Folyamatos növények
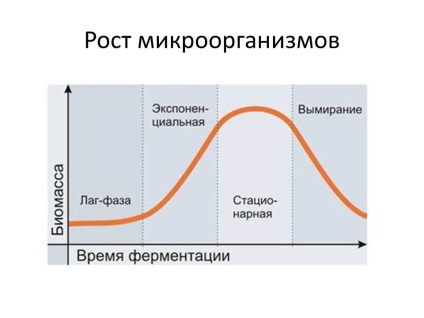
A 20. század 50-es évében kifejlesztették a mikroorganizmusok folyamatos termesztésének módját (az áramlástermesztés módszere). A módszer lényege, hogy a kultivátor, ahol a baktériumokat termesztik, folyamatosan friss tápanyagot kap, ugyanakkor a tenyészfolyadékot ugyanolyan sebességgel visszavonják. Ennek eredményeképpen a mikrobiális körülmények mindig létrejöttek a tápanyagok rendelkezésre állása és gyakorlatilag nem cserélhető termékek tekintetében. Az áramló közeg sebességének szabályozásával lehetõség van a baktérium populáció fejlõdésének szabályozására, például arra, hogy sokáig tartsák a tenyésztést a logaritmikus növekedési fázisban.
A folyamatos termesztés speciális eszközökön - kemosztátok és turbidosztátok. A kemosztátokban a tenyészet növekedését a szubsztrát koncentrációja szabályozza. Konstans szinten tartható a koncentrációja az egyik kötelező szubsztrátok (nitrogén vagy szén-dioxid-forrás) szabályozásával áramlási sebessége a közeg, lehetőség van, hogy stabilizálja a növekedési üteme a kultúra és a népsűrűség. A tápközeg nagy áramlási sebességénél a tenyészet növekedése intenzívebb és megközelíti a maximális értéket; kisebb mértékben - lassabban, az aljzat korlátozott adagolása miatt. Azonban, növeljük az áramlási sebességet, hogy megszüntesse a korlátozásokat a növekedési szubsztrát kultúra vezet kimosódás a kultúra, csökkenti a népsűrűség.
A kemosztátokkal ellentétben a turbidosztát alapelve a tápközeg áramlási sebességének a lakosság sűrűségével történő szabályozása. A turbidosztátban a népsűrűséget a tápellátást szabályozó reléhez csatlakoztatott fénysorompó vezérli. Amint a lakosság sűrűsége eléri az előre meghatározott szintet, a relé aktiválódik, és friss tápközeg kezdődik a kultivátorba. Ennek eredményeként a sejtek koncentrációja egy bizonyos szintre csökken, ami után a tápellátás automatikusan kikapcsol. A turbidosztát esetében a tenyészet maximális növekedési ütemét nagyobb népsűrűséggel és nagyobb pontossággal érjük el a táptalaj bejutásának szabályozásában.
A mikroorganizmusok áramló termesztését a mikroorganizmusok fiziológiájának tanulmányozására használják, tk. lehetővé teszi számukra, hogy ellenőrzött körülmények között termeljenek. Ez a módszer széles körben alkalmazható a mikrobiológiai iparban, tk. lehetőséget ad a mikroorganizmusok bioszintetikus folyamatainak szabályozására.

A tiszta mikroorganizmus tenyészetek izolálása
A tiszta kultúra egy olyan kultúrára vonatkozik, amely ugyanazon fajú mikroorganizmusokat tartalmaz. A tiszta baktériumtenyészetek izolálása a bakteriológiai kutatás kötelező stádiuma a fertőző betegségek laboratóriumi diagnózisában, a különböző környezeti objektumok mikrobiológiai szennyeződésének tanulmányozásában és általában a mikroorganizmusokkal végzett munkákban. A vizsgált anyag (genny, köpet, ürülék, vér és más anyagok a betegekből, a vízből, a talajból, a levegőből, az élelmiszerből, az állati és emberi testből, hordozókból) általában mikrobiális szöveteket tartalmaz.
A tiszta kultúra izolálása lehetővé teszi a morfológiai, kulturális kutatások tanulmányozását. biokémiai, antigén és egyéb jelek, amelyek aggregátuma meghatározza a kórokozó fajtáját és típusát, vagyis annak azonosítását végezzük.
A tiszta mikroorganizmus tenyészetek izolálására olyan módszereket alkalmaznak, amelyek több csoportra oszthatók.
- A Pasteur módszere a folyékony tápközegben lévő vizsgálati anyag szekvenciális hígítása egy térfogatú sejt koncentrációjához (történelmi jelentőséggel bír).
- Koch módszere ("lemezes huzalozás") - a vizsgált anyag szekvenciális hígítása megolvasztott agarban (48-50 ° C hőmérséklet), majd Petri-csészékbe áramlik, ahol az agar megszilárdul. Vetés teszi, mint általában, a három vagy négy utolsó hígítás, ahol a baktériumok lecsökken, és a jövőben a növekedés Petri-csészék jelennek izolált telepeket kialakítva az egyik az eredeti anyasejt. Az izolált kolóniákból az agar mélységében tiszta baktérium tenyészetet nyerünk friss táptalajba való újratelepítéssel.
- A Shukevich-eljárást a fehérje és más "kúszó" növekedésű mikroorganizmusok tiszta tenyésztésére használják. A vizsgált anyag vetését a lehúzott agar alján lévő kondenzvízben végezzük. Mozgatható mikrobák (proteák) képesek felmászni a levágott agart. Még mindig a formák tovább nőnek a vetés helyén. A tenyészet felső széleinek átültetésével tiszta tenyészetet nyerhetünk.
- Drigalsky módszerét széles körben használják a bakteriológiai gyakorlatban, míg a vizsgálati anyagot steril sóoldattal vagy hígítóval ellátott kémcsőben hígítjuk. Egy csepp anyagot viszünk be az első edénybe, és egy steril üvegspatulát terítünk a táptalaj felületére. Ezután ugyanazzal a spatulával (égetés nélkül az égő lángjában) ugyanazt a vetést végezzük a második és a harmadik csészében. A baktériumok minden vetésén a spatulán egyre kevésbé maradnak, és amikor a harmadik csészébe vetettek, a baktériumokat a tápközeg felszínén elosztják egymástól. Miután 1-7 napig inkubátorban tartása csésze (attól függően, hogy a mikroorganizmus növekedési ütem) a harmadik csésze ad minden baktérium-sejt-klónt izoláltunk kolóniaképző amelyek átoltjuk ferde agar annak érdekében, hogy felhalmozódnak a tiszta tenyészet.
- Weinberg módszere. Különleges nehézségek merülnek fel a kötelező anaerob tiszta kultúrák elkülönítésében. Ha a molekuláris oxigénnel való érintkezés nem okoz azonnal halálos halálesetet, akkor a termést a Drigalsky módszerrel állítják elő. de ezután a csészék azonnal az anaerosztátba kerülnek. Azonban a tenyésztési módszert gyakran használják. Lényege abban áll, hogy a vizsgált anyag hígítását olvasztott és lehűtött 45-50 ° C-os agar tápközegben végezzük. 6-10 egymást követő hígítást végzünk, majd a kémcsövekben lévő táptalajt gyorsan lehűtjük, és a felületet paraffin és vazelinolaj elegyének rétegével lefedjük annak érdekében, hogy megakadályozzuk a tápközegbe való bejutást. Néha a vetés és a keverés után a tápközeg steril Burri csövekbe vagy Pasteur kapilláris pipettákba kerül, amelyek végei lezárva vannak. A tesztcsövek sikeres hígításával, Burri csövek. A Pasteur pipetták elszigetelt anaerob telepeket hoznak létre. Az elszigetelt telepek jól láthatóvá tételéhez tisztított tápanyagot használjunk. Az izolált anaerob telepek kivonásához a csövet kissé felmelegítik, a láng felett forgatják, míg az agart. a falakkal szomszédos, olvad és a cső tartalma agaroszlop formájában kerül egy steril Petri-csészébe. Az agarlemezt steril csipeszekkel vágjuk, és a telepeket hurokkal eltávolítjuk. Az extrahált kolóniákat olyan folyékony közegbe helyezzük, amely kedvező a szekretált mikroorganizmusok kifejlesztéséhez (pl. Kitt-Tarozzi táptalaj). A Burri-csőből származó agarizált táptalajt felrobbantották, és a gázot egy nedves parafából vezette át.
- A Tömörítés módszere - amikor el kívánják szerezni az oxigénnel szembeni különösen nagy érzékenységű baktériumok elkülönített telepeit (szigorú aerobok), használják a csövek elforgatásának módját. Erre a célra az olvadt agar táptalajt baktériumokkal inokuláljuk egy állandó áramban egy oxigénszennyeződéstől mentes inert gázt tartalmazó kémcsövön keresztül. Ezután a csövet gumidugóval lezárjuk, vízszintesen elhelyezzük a kapcson, a csövet forgatjuk, a tápközeg egyenletesen eloszlik a cső falán, és egy vékony réteggel szilárdul meg. Egy vékony réteg alkalmazása gázkeverékkel töltött kémcsőben lehetővé teszi olyan elkülönített telepek előállítását, amelyek tisztán láthatóak a szabad szemmel.
- Az egyes sejtek izolálása mikromanipulátorral. A mikromanipulátor olyan eszköz, amely lehetővé teszi, hogy egy sejtet a szuszpenzióból speciális mikropipettával vagy mikrohurokkal extraháljunk. Ezt a műveletet mikroszkóp alatt figyelik. Nedves kamrát helyeznek a mikroszkóp szakaszra, amelybe a "lógó csepp" készítmény kerül. A működtető állványok tartóinál mikropipetták (mikro-hurkok) vannak rögzítve, amelyek mozgása mikroszkóp szempontjából mikron pontossággal történik csavarok és karok rendszere révén. A kutató mikroszkóppal átnézve kivonja az egyes sejteket mikropipettákká, és steril folyékony közeggel áthelyezi azokat a kémcsövekhez, hogy sejtklónt kapjanak.