A megoldások elektromos vezetőképessége
Az elektromos vezetőképesség (L) az anyag azon képessége, hogy elektromos áramot végezzen egy külső elektromos mező hatására. A fizikai értelemben ez az érték inverz az ellenálláshoz (R):
ahol # 961; - ellenállás, Ohm / m; S - a vezető keresztmetszete, m 2; l a vezetõ hossza, m.
Megkülönböztetni az elektrolit oldatainak egyedi és mágneses elektromos vezetőképességét.
Specifikus elektromos vezetőképesség (# 954;) egy olyan oldat térfogatának elektromos vezetőképessége, amely 1 m 2 egymástól távol eső két párhuzamos elektróda között van. A fajlagos elektromos vezetőképesség az ellenállás kölcsönössége.
A fajlagos elektromos vezetőképesség mérési egysége: Ohm -1 m -1 = S / m (cm - Siemens).
Az elektrokémia során gyakran alkalmazzák a fajlagos elektromos vezetőképesség hagyományos meghatározását: az 1 cm hosszúságú és 1 cm 2 keresztmetszetű anyag oszlopának elektromos vezetőképessége. Ebben az esetben az Om-1 cm-1 mérete S / cm.
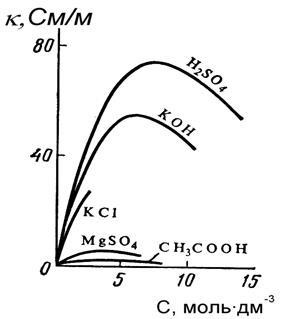
Fajlagos elektromos vezetőképesség az elektrolit által meghatározott számát és felelős az ionok hordozó villamos, valamint azok sebessége egy elektromos mező. Függőségi grafikon # 954; az oldat koncentrációja az erős elektrolitokhoz egy olyan görbe, amely egyértelműen kimondottan maximális és gyenge - ez a maximum nagyjából elmosódott és gyakorlatilag nem jelenik meg (5.1. ábra). Az erős és gyenge elektrolit oldat kis koncentrációjának területén az elektromos vezetőképesség növekedése a villamosenergia-ionhordozók számának növekedésével magyarázható.
A koncentráció növekedésével nő az oldat sűrűsége, ami csökkenti az ionok sebességét, míg a gyenge elektrolitokban a disszociáció mértéke jelentősen csökken; ezért # 954; mivel a mérsékelten gyenge elektrolitok a sokkal hígabb oldatok térségében csökkennek, és gyakorlatilag nem nő az elektromos vezetőképesség, és a görbe legmagasabb értéke nagyon lapos.
hőmérséklet-növekedése 1 K növeli a vezetőképessége 2-2,5% erős elektrolitok csökkentésével az oldat viszkozitása és a tömítések hidratált ionok, és a megoldások gyenge elektrolitok - növelésével disszociációs mértéke az endoterm reakciók esetében az elektrolit oldott.
Az adott elektromos vezetőképesség értékét a felsorolt tényezőkön kívül az ion valenciája (töltése) is befolyásolja: minél nagyobb az iontöltet, annál nagyobb az áram.
A moláris elektromos vezetőképesség (# 955) - a villamos vezetőképessége a térfogatú elektrolitot tartalmazó oldat 1 mól ekvivalens az oldott anyag között elhelyezett két párhuzamos elektróda egymástól 1 m távolságra. A moláris elektromos vezetőképesség mérési egysége: Lásd # 8729; m 2 / mol.
A specifikus és a mágneses elektromos vezetőképességet a kapcsolat:
ahol C az oldott anyag moláris koncentrációja, mol / l; # 955; - moláris elektromos vezetőképesség, cm # 8729; m 2 / mol; # 954; - Specifikus elektromos vezetőképesség, S / m.
függőség # 955; az egyszeres monovalens ionokra vonatkozó mozgási sebességet az alábbi egyenlettel fejezzük ki:
ahol u + és u- a pozitív és negatív ionok abszolút sebessége, # 945; - az elektrolit disszociációjának foka, F - Faraday konstans.
Erõs elektrolitok esetén egy = 1 lehet
A termékeket ionos mobilitásnak nevezik:
A rendkívül híg oldatok (C → 0, # 945; → 1) a következő egyenlőség tartja:
ahol u a határ (végtelen) hígításban lévő ionmobilitás, az ionokra vonatkozó specifikus értékek; - az elektromos vezetőképesség egy hipotetikus végtelenül hígított oldat, azzal jellemezve, hogy egy teljes disszociációja az elektrolit és a hiánya erők közötti elektrosztatikus kölcsönhatásokat az ionok.
Az (5.25) egyenlet mind az erős, mind a gyenge elektrolitokra érvényes, és a Kohlraus ionok független mozgásának törvénye (az elektromos vezetőképesség additivitási törvénye). A Kohlrausch-törvény értelmében a korlátozó hígításban a moláris elektromos vezetőképesség megegyezik az ionok mobilitásának összegével a korlátozó hígításban.
Az ionmobilitás számszerű értékeit jelenleg gyakorlatilag minden ionra becsülik, és a referencia-könyvekben szerepelnek. Például referenciaadatok felhasználásával meghatározható a rendkívül hígított ecetsavoldat moláris elektromos vezetőképessége:
A különböző ionok számértékének összehasonlítása azt mutatja, hogy a hidroxio-nium-hidroxid és a hidroxilionok a vizes oldat elektromos vezetőképességének abnormálisan magas értékét hordozzák. Ezt az oldatokban lévő ionok elmozdulásának relé mechanizmusa magyarázza. Ezért a savak és a lúgok oldatai, összehasonlítva az azonos koncentrációjú sóoldatokkal, nagyobb elektromos vezetőképességgel rendelkeznek.
A gyenge elektrolitok híg oldataiban az ionok közötti elektromos kölcsönhatás kicsi, ezért:
Az (5.26) kifejezésből következik, hogy a gyenge elektrolit oldat disszociációjának mértéke a koncentráció változásával meghatározható híg oldatainak mágneses villamos vezetőképességére vonatkozó kísérleti adatok felhasználásával. Mivel az elektrolit állandó, a gyenge elektrolit híg oldatának elektromos vezetőképességének megváltozása a koncentrációjának megváltozásával csak az a koncentráció függvényében függ az oldat koncentrációjától.
Az erős elektrolitok oldatában a mólos elektromos vezetőképesség koncentrációval történő változása az ionok elektrosztatikus kölcsönhatásának hatására a mozgás sebességével függ össze.
A mágneses vezetőképességnek a gyenge elektrolitok koncentrációjára gyakorolt függőségének grafikonát a növekvő koncentrációval meredekebb meredekséggel fejezzük ki, mint az erős elektrolitok esetében ugyanazon függőség görbéje (5.2 ábra).
Ábra 5.2. A gyenge (1) és az erős (2) elektrolit koncentrációban lévő oldatainak mágneses elektromos vezetőképességétől függ.
Számos kutató tanulmányozta az oldat moláris vezetőképességének az erős elektrolit koncentrációjára való függését. A higított oldatok empirikus Kohlrausch egyenlete a legismertebb, a négyzetes gyökértörvénynek nevezett:. (5.27) ahol h az empirikus együttható. Ezt a függést számos kísérlet megerősíti, és a Debye-Hückel-Onsager-elméletben elméletileg alátámasztott.
Ezen elmélet szerint, a csökkenés a moláris elektromos vezetőképessége a híg oldatok erős elektrolitok növekvő elektrolit koncentráció csökkenése miatt a mozgás sebessége az ionok miatt az elektrosztatikus kölcsönhatások ionok körül ionos atmoszféra, a mozgás az ionok elektromos mező.
Konduktometria - kutatási módszer mérésén alapul villamos vezetőképessége elektrolit oldatok. Ez a módszer elég egyszerű, pontos, lehetővé teszi számos fontos kutatási és gyártási feladat megoldását. Mérési az elektromos vezetőképesség az oldatok, meghatározó bázicitása szerves savak, az oldhatóság és a oldhatóságú termékek rosszul oldódó vegyületek és a foka disszociációs állandója a gyenge elektrolit, a mértéke az mineralizáció a talaj, a víz és a talaj. Különböző (különösen zavaros) megoldások széles körben alkalmazott vezetőképességi titrálása.
Kísérleti meghatározása az elektromos vezetőképessége az elektrolit oldat az oldat össztömegére számítva ellenállást mérjük áthaladó elektromos áram kompenzációs módszer. Ehhez egy hídkört használnak (5.3 ábra):
5.3 ábra. Az oldat elektromos ellenállásának mérésére szolgáló szerelési séma: AB - Rechord rögzített ellenállási értékekkel a C csúszó érintkező különböző helyzeteiben; Rm - ellenállás tároló; Rx - vizsgálati oldattal ellátott edény, amelynek ellenállását meg kell határozni; G - nulla szerszám (galvanométer vagy oszcilloszkóp); - nagyfrekvenciás áramfejlesztő.
A C érintkezőt a rheochord AB-n keresztül mozgatva az áram vagy a minimális áram hiánya érhető el a CD áramkörben. A következő kapcsolat érvényes :. innen:
A nagyfrekvenciájú váltakozó áram (a mérési áramkörben) arra szolgál, hogy elkerülje az elektrolízis hatását az edényben lévő elektródákra a vizsgálati oldattal és csökkentse a kapacitív ellenállást.
5.3. Példa. Két nikkel lemezek, amelynek területe 4 cm2 egyes, párhuzamosan vannak elrendezve, hogy egymással a parttól 11 cm. A tér között van töltve 0,34 M NiSO4. Az oldat moláris elektromos vezetőképessége 98,7 S / cm2 / mol. Milyen váltakozó feszültséget kell alkalmazni a lemezekre úgy, hogy a jelenlegi szilárdság 0,07 A?
1. Az oldat ellenállásának kiszámításához kiszámítjuk a fajlagos elektromos vezetőképességet a moláris elektromos vezetőképesség értékeiből:
2. Számítsa ki a megoldás ellenállását:
3. Az Ohm törvény szerint kiszámítjuk az elektródákra alkalmazott feszültséget:
5.4. Példa. A 0,05 M ammónium-tiocianát oldat fajlagos elektromos vezetőképessége 0,572 × 10-2 S / cm. Számítsd ki a só disszociációjának mértékét.
1. A mól elektromos vezetőképességét az (5.21) egyenlettel számítjuk ki:
2. Az összehasonlításhoz megtaláljuk az ionok mobilitási értékeit és kiszámoljuk az egyenlet (5.25) szerint:
3. Az ammónium-tiocianát disszociációjának mértéke az alábbi egyenlettel számolható ki (5.26):
5.5. Példa. A 0,02 M ecetsavoldat moláris elektromos vezetőképessége 12,77 cm2 / mol. Számítsuk ki az oldat disszociációs állandóját és pH-ját.
1. A referencia adatok szerint 25 ° C-on az ecetsav korlátozó moláris elektromos vezetőképessége:
2. Számítsa ki az ecetsav disszociációjának mértékét (5.26):
3. Számítsa ki az ecetsav disszociációs állandóját az (5.2) egyenlet segítségével:
4. Mivel az ecetsav gyenge elektrolit, a sav elektrolitikus disszociációja következtében keletkező hidrogénionok koncentrációja a következő:
5. Számítsa ki az ecetsavoldat pH-ját:
Az elektrolízis olyan eljárás, amelyben a kémiai reakciók külső forrásból származó elektromos áram hatására fordulnak elő, miközben az elektromos energiát kémiai úton alakítják át. Elektrolízissel olyan reakciókat hajthatunk végre, amelyek spontán áramlása lehetetlen.
Az elektrolízist elektrolitikus sejtekben (elektrokémiai cellákban) végzik, amelyek az elektrolit oldatba merített két elektródából állnak.
A negatív töltésű elektród, amelyen a redukció (elektronok csatlakoztatása) történik, katódként nevezik:
Egy pozitív töltésű elektróda, amelyen az oxidációs folyamat megtörténik (elektronok kibocsátása) anódnak nevezik:
Az elektrolízis eredményeként az elektródákat elválasztják az elektrolit oldatától, és összetétele megváltozik az elektródák felületén. Az elektrolízis során bekövetkező kémiai átalakítások az elektrolit és az oldószer természetétől, az elektród anyagtól és az oldat egyéb anyagainak jelenlététől függenek.