Koprológiai módszerek
Halál előtti diagnosztizálására a legtöbb helmintiázis meghatározott cop rologicheskimi kutatási módszerek detektálásával bélférgek vagy azok fragmensei (gelmintoskopiya), szexuális termékek - tojás (lámpázást) vagy lárvák (larvoskopiya).
Az állatok frissen izolált ürülékeiben lehetséges a cestode szegmensek (anoploccephalidae) kimutatása. Néha ürülékkel nagy fonálférgeket (paraszkár, oxiurid, sztirózis) lehet szétosztani. Azonban ez a jelenség véletlenszerű jellegű, és különböző okok miatt fordul elő, és nem kapcsolódik a paraziták biológiai jellemzőihez.
A csecsemők és a kis fonálférgek szegmenseit a széklet egymást követő mosásának módszerével mutatják ki. A pusztaságokat az üledék választja ki és a morfológiai jellemzők szerint differenciálják.
A legtöbb helminthiasis in vitro ovoscopos módszerekkel diagnosztizálható. A helmintojások fajsúlyától függően a székletből leválasztással vagy úszóval (flotáció) izolálhatók (292. ábra).
A tojás trematodái nehezebbek, ezért az egymást követő mosások módszerével kicsapják.
Az egymást követő mosások módszere. A kutatás elvégzéséhez a következőket kell megkövetelni: a) habarccsal (a távolléte esetén egy kanna és egy kanál); b) tölcsér; c) 100-150 ml-es (előnyösen hengeres) üvegkazettát; d) 12 x 12 cm méretű fém háló vagy gézszalag; e) csúsztassa meg a poharakat.
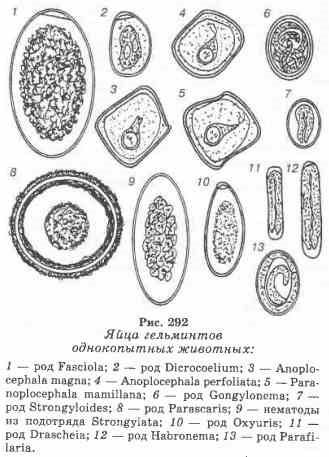
Ábra. 292 Patás állatok bélférgei:
Az egymást követő mosások módszerét az állatok fascioliasisának és mikrokoloiózisának diagnosztizálására használják.
Tojás fasciola - nagy, szabályos ovális alakú, fedéllel az egyik póluson, szemcsés tömegű belsejében és arany sárga színű héjakkal.
A mikrokémia tojása kicsi, aszimmetrikusan ovális alakú, a miracidia lárvái belsejében és barna színű kagylók.
A coccidia legtöbb bélférgének és oocisztájának tojásainak azonosítása a lebegés (flotáció) koprológiai módszereit használja. A legegyszerűbb módszerek a helminthiázisok koprológiai módszereinek elvégzésére, amelyek nem igényelnek különleges felszerelést és anyagokat, a Füleleborn és a Kotelnikov módszerei. Mindkét széklet kutatási módszert alkalmazhatjuk a termelési körülmények között. A kutatás elvégzéséhez ezek a módszerek megegyeznek a szekvenciális mosás módszerével. A héjas tojás flotációjához bizonyos sűrűségű sók oldatainak előállítása szükséges.
A Fuhleborne módszer. A Füllbourn vizsgálat elvégzéséhez telített közegben (NaCl) készült oldatot készítünk. A csészékben lévő forró vízzel tegye asztali só (alapuló 400-420 g só 1 liter víz), és forrásban lévő folytattuk enyhe melegítéssel, amíg, amíg a só oldott megáll (a doboz alját feloldatlan nem marad sót, és úgy tűnik, a felszínen a folyadék vékony film). A szerepet a forró állapotban egy réteg vatta vagy géz átszűrjük. Az oldat lehűlése után a doboz alját esik kivált sót (előjelhelyesen készítmény kívánt koncentrációjú oldat). Használat a munka felülúszójában üledék keverése nélkül.
Egy részét a bélsár vizsgálták mennyisége körülbelül 10 g-ot helyeztünk egy mozsárban, adjunk hozzá mintegy 80-100 ml telített nátrium-klorid-oldattal, és alaposan elkeverjük egy mozsártörővel (anélkül, intenzív dörzsöléssel bélsár), amíg egy egyenletes szuszpenziót. A szuszpenziót átszűrjük egy fém szitán vagy egy egyrétegű cheesecloth egy hengeres üveg (vagy bank), amelynek kapacitása 100-150 ml, és hagyjuk állni 10-15 percig, majd eltávolítjuk a folyadék felszíne fecalith cal-hurkos szalagot, hogy t átvisszük egy tárgylemezre mikroszkópos vizsgálat . Kívánatos, hogy legalább három filmet vizsgáljunk a csészében lévő folyadékfelület különböző szakaszaiból. Szabványos koprologiche-iai hurkot lehet vékony vörösréz huzal (a sodrott elektromos vezeték vénába) 10-12 cm hosszú, csavaró végénél egy gyűrű alakú hurok egy kerek ceruza felhúzott hurok és 90 °. Újrafelhasználható hurok. Használat előtt éget az égő lángján vagy alaposan mosható.
A film folyékony helyezni, tárgylemezre azonnal meg kell vizsgálni, mert, ha a kiszáradás, a sókristályok esik akadályozó kimutatására féregpetéktől. Módszer Fyulleborna távolságra elkülönített összes féregpetéktől, azonban kívánatosabb lenne módosítás - Kotel'nikova módszert, amely végre ugyanezen eljárás szerint, de a flotációs folyékony ammónium-nitrát-oldatot használunk. Sűrűség alkalmazott nitrát oldat lényegesen magasabb, mint a telített sóoldat, azonban kialakulni szinte minden tojást bélférgek (trematódák kivéve tojás).
A Kotelnikov módszer. A flotációs folyadékot fel kell állítani a granulált ammónium-nitrát (amelyet agronómiai ásványi trágyaként használnak) feloldása forró vízben. 1 liter vízhez 1500 g salétátot kell venni. A sósavat fokozatosan feloldjuk állandó (de nem forrásban lévő) melegítéssel! Vízből és szorosan lezárt edényekben tároljuk.
A Kotel'nikov módszerrel végzett ürülékvizsgálat ugyanúgy történik, mint a Füllbourn módszer, de az ürülékeket 5 g mennyiségben veszik fel, és a niter oldata nem több, mint 50 ml. A székletet a flotációs oldatban 10 percig állni hagyjuk. A Kotel'nikov módszerének előnye nem csak a nagyobb hatékonyság és sokoldalúság, hanem az iszap folyadék felületi filmje nem tartalmaz nagy ürülék- és habrészecskéket, amelyek zavarják a paraziták tojásait.
Flotációs módszerek az állatok széklet tömegében fonálférgek - paraszkár, strongylitis, strongyloidok, rongyok és gyertyánok tojása, valamint a cestodák tojása.
Parascaris tojás - közepes méretű, kör alakú, vastag kagylós, sárgásbarna színű. A tojáson belül egy finom szemcsézetű embrionális gömb látható, néha a zúzás szakaszában.
Tojás strongylite - közepes méretű, hosszúkás ovális, vékony kettős héjhéjjal, szürke. A tojásokon belül egy csírázó golyó látható a zúzás szakaszában ("zúzási golyók"). Az összes sztrangiták tojása ugyanolyan szerkezettel rendelkezik, és lehetetlen megállapítani generikus tartozékukat. A diagnózis csak a "strongylatózis" aljzatra van alapozva.
Az in vivo általános tojáshoz tartozó állatok esetében a sztrongját a meghatározott körülmények között állati ürülékben termesztett invazív lárvák határozzák meg.
Strongyloididok kicsi, kerek-ovális alakúak, vékony, sima héjú, szürke színű. A tojásokon belül látható egy "hajtű" alakú hajtogatott lárva.
A strongyloididok tojásaiból a külső környezetben kedvező körülmények között a lárva 6-7 órán belül elhagyható.
Tojás és Drash gabronem kicsi, hosszúkás-tojásdad, tompa végű, vékony, lágy héjú, világos szürke, lárvák összeomlott alkotnak „hajtű”. Bár a tojás Drash és flotációs módszerek gabronem észlelt (a módszer Kotel'nikova), koncentrált sóoldatok deformálja azokat. Ezért ajánlott Gorshkova speciális módszerrel (lásd. Larvoskopichesky eljárás Berman-Orlova) elkülöníteni őket a széklet.
Anoplocephalus tojás. Középméretű cestode-anoploccephalidae tojás, szabálytalan alakú poliéder formájában (általában négyszögletes, lekerekített sarkoknál), vékony héjakkal, sötétszürke színű. Belsejében láthatóak a kerek formájú, saját héjukba záródó körmök, amelyek szarvakkal ellátott oldalirányú kiemelkedésekkel ("körte alakú készülék") láthatóak.
Az oxuris tojása közepes méretű, ovális aszimmetrikus, vastag, két kontúrhéj, világosszürke színű, nyálkahártyával az egyik póluson. A tojáson belül egy finom szemcsés tömeg látható.
Az oxuris tojás a test prianális területének bőrén található, és egy 50% -os glicerin oldattal mártott fadarabot vagy 50% glicerint tartalmazó vattapálcát vonszol le a bőrfelületről. A szappanbuborékból csúszkát készítenek egy zúzott cseppből és mikroszkóp alatt vizsgálják. Az invazív állatok ürüléktömegében az oxyauris tojások ritkán találhatók.
A széklet elválasztására, a bélféregek lárvái belső szervére és szöveteire, a helmintholarvoszkópos módszereket alkalmazzák. Legtöbbször erre a célra a Berman-Orlov és Shcherbovich módszereit használják.
A vizsgálati ürüléket az állatok végbéléből kell venni, és friss formában kell vizsgálni úgy, hogy a külső környezetben legfeljebb 68 óra legyen. Ha ez a feltétel teljesül, akkor az összes észlelt lárvák a pulmonalis bélférgekhez tartoznak, amelyek megkülönböztetése nem nehéz. Az emésztőrendszer bélférgének lárvái a külső környezetben fekvő székletben jelennek meg, amelyből meg kell különböztetni a dictyocaul lárváit, ami nagymértékben bonyolítja a diagnózist.
A Berman-Orlov módszer. A Berman-Orlov módszerrel történő széklet vizsgálatához a) egy tölcsér szükséges, amelynek végén 12-15 cm hosszú gumitömeget helyeznek el; b) kúpos centrifugacső vagy gumi cső; c) 20 x 20 cm-es fémszűrőt vagy gézszalagot; d) állványt vagy más eszközt a tölcsér rögzítéséhez függőleges helyzetben.
Végén a gumicső hozott egy centrifugacsőbe, szorosan elakadt ez (vagy annak hiányában a bilincs cső). A tölcsér vizet öntöttünk szobahőmérsékleten vagy melegítjük 35-40 ° C-on, korrigált szűrővel, úgy, hogy az elegyet enyhén merítve a vízbe, és ez kerül a széklet állatokból mennyiségben 5-10 hiányában sziták széklet csomagolva egy réteg géz és vízbe merítve. Széklet tartottuk vízben 6-12 órán át, ami után óvatosan csipkedte a gumicső, a csövet eltávolítjuk. A kémcsőben lévő folyadékot 510 percig állni hagyjuk, vagy centrifugáljuk 1000 fordulat / perc sebességgel egy percig. A felső réteg folyadékot egy kémcsőbe öntjük óvatosan egy csapásra úgy, hogy a cső marad 0,5-1 ml folyadék, amely öntjük csúszdák mikroszkópos (jobb, ha erre a célra használt speciálisan vágott ablakok nagy mérete, ami azonnal helyezze az egész az anyag vizsgált része).
A Berman-Orlov-eljárást gyakran használják laboratóriumi körülmények között. A gyártási körülmények között általában módosításokat alkalmaznak.
Ugyanezt a módszert alkalmazzák a patás állatok ürülékének tanulmányozására a drachiosis és a gabronematosis diagnózisában. Helyezze szobahőmérsékletű vizet a tölcsérbe. Szereljen fel egy fém hálót, úgy, hogy vízbe merült, lazán 100-200 g székletet helyezett és 10-12 órán át tartott. A fonálférgek tojásait kimostatják a székletből, és a tesztcső alján ülepednek. Vizsgálja meg az üledéket, amely a kémcső alján található.
Shcherbovich módszere. A vizsgálatot a Shcherbovich-módszerrel végezzük, a) 50-100 ml kapacitású kúpos vagy hengeres csésze szükséges; b) gézszalvéta (15 x 15 cm); c) diák és fedőlemezek; d) 10 cm hosszú vékony, puha rézhuzal szegmense.
Az üveget szobahőmérsékleten öntjük, vagy 35-40 ° C-ra melegítjük, a tartály kapacitásának 2/3-át. Az állati végbélből vett ürülék, egy réteg gézzel, rézhuzalral kötözve, hogy a vezeték egy része szabad maradjon. A drót szabad vége hajlított, amelyre a gézbe burkolt széklet lóg az üveg szélén, hogy megérintsék a vizet. A limóban lévő ürüléket 5-6 órán át hagyjuk, majd óvatosan eltávolítjuk, és az üvegben maradt folyadékot további 5-10 percig megvédjük. Az iszap után a folyadék felső réteget alaposan eldobjuk, így 0,5-1 ml csapadékot hagyunk az üvegben, és mikroszkópos csúszkákba visszük át.
Az larvoszkópia módszere a fonálféreg-diktiokaula lárvák parazitálását előidéző állatok ürülékében található.
A lárvák diktiokaulov mérete 0,4 mm hosszú, rövid farka és hegyes lekerekített fejvégek, sötét szürke színű. lárva test van töltve szemcsés tömeget (kivéve a fej és a farok végződik). A lárvák belső szerkezete rosszul látható. A lárváknak lassan kígyózó mozgása van.
Larvaszkopikus módszereket különböztethetünk meg egyes fonálférgek vándorló lárvái különböző szervétől és szövetétől (a tüdőből, a májból és más szervekből).
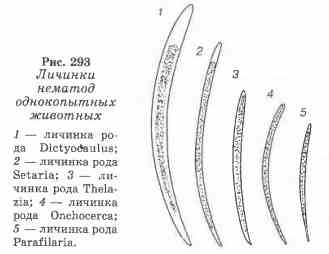
Patás állatok fonálférgének lárva
Az állatok vérét megvizsgáljuk, ha paraphilária és szafarózis gyanúja merül fel.
A paraphilária diagnosztizálása. A megjelenése vérző sebek a bőrön egy állat meleg évszakban ad okot, hogy vizsgálja meg a vér jelenlétére lárvák férgek. Erre a célra a pipetta dial szemészeti vérzés bőrsérülések csepp vért átvisszük egy üveglemezre (előnyösen egy speciálisan vágott nagy méretű üveg, körülbelül 5 x 10 cm) adunk hozzá 5-10 csepp desztillált vizet (lízisére vörösvértestek) és mikroskopiruyut gyenge nagyítás. Mozgó lárvából mérete körülbelül 0,2 mm, megtöltjük a szemcsés tömeget zöldes, kisebb tojást vagy ovális szürke lárvák belsejében.
A setaria (microsetarium) lárvái megtalálhatók az állatok perifériás véréből készített kenetek vizsgálatában, és a Romanovsky-Giemsa módszerrel festettek. A keneteket este kell előkészíteni, amikor a perifériás vérben lévő mikrosejtek száma növekszik. A 0,3 mm hosszú, szemcsés szerkezetű, a hüvelyben lévő, a fej és a farok végén jól látható setária lárva. A lárvák hátsó részén 4-5 nagy sejt látható.
Gyanúja onchocerciasis vizsgált bőrdarabokat dermolar-voskopii kimutatására szolgáló eljárás lárva onhotserkov (mikroonhotserkov). Ehhez, az érintett területek a bőr a régióban a mar, vállak és a mellső lábak ollóval vagy szikével kivágott darab bőrt akkora, mint egy kis borsó, és 2-3 mm vastag.
A kivágott darab bőrt helyezünk egy kémcsőbe egy kis mennyiségű sós és inkubáltuk 1-2 órán keresztül termosztátban hőmérsékleten 36-3 7 ° C, ekkor a csapadékot vizsgáltuk. Pozitív esetben, a mozgatható lárvák mikroszkópos felfedi a szemcseszerkezet (nélkül Case áll) körülbelül 0,25 mm-es méret.
A szemvizsgálatot akkor hajtják végre, ha gyanúja telázisznak a bélférgek vagy lárvái felderítésére.
A páncélszekrényeket a kötőhártya tasakból egy 1% -os bórsavoldattal, egy puha hegyű gumi körettel lehet mosni. A körte végét a kötőhártya tasakba injektáljuk, és a bórsav oldatot a szemmel öblítjük. Az áramló folyadékot egy küvettában gyűjtjük össze és alaposan megvizsgáljuk. A füles fonálférgek, amelyek a szemtől lemosva és körülbelül 1,5 cm méretűek, aktívan mozognak és könnyen észlelhetők.
A borjak lárvái észlelhetők az állat szeméből vett könnycsepp mikroszkópos vizsgálatával. Ehhez a szemgolyó óvatosan összegyűjti könnycseppfolyadékot a szem belső sarkából, egy diára van helyezve és mikroszkóposan. A 0,3 mm vastagságú, szemcsés, csehországi borjúlárva tevékenyen mozog.