Bohr posztulátumát
1913-ben három kísérleti tények nem magyarázható a klasszikus fizika:
- Empirikus minták a vonal spektrumát a hidrogénatom, a képlet kifejezve Balmer - Rydberg.
- Rutherford nukleáris atom modell.
- A kvantum jellege emissziós és abszorpciós fény (hősugárzás és a fényelektromos hatás).
Ahhoz, hogy nehézségek megoldása Bohr (dán tudós) megfogalmazott három posztulátumokat hidrogén és hidrogén atomok - magját töltés Ze és egy elektron mozog az atommag körül.
I - én posztulátum - axiómája stacionárius állapot:
A rendszerben vannak olyan nyugalmi állapot, amely nem változik az idő múlásával anélkül, hogy külső hatások. Ezekben az államokban az atom nem bocsát ki fényt.
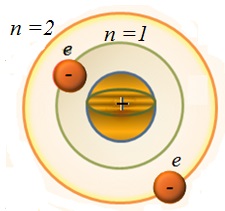
Az egyensúlyi állapot, egy elektron az atom mozog egy körpályán a gyorsulás nem bocsát ki fényt, meg kell diszkrét (kvantált) értéke a perdület
III - Az első posztulátum - általában kering:
Sugárzást bocsátanak vagy abszorbeált fény egy kvantum energia elektron átmenet az egyik egyensúlyi állapotból a másikba.
A világító fotonenergia különbséggel egyenlő a stacionárius állapot között, amely egy elektron átmenet bekövetkezik
.
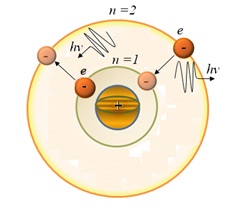
A lehetséges diszkrét frekvenciák
Quantum átmenetek és meghatározza a vonal spektrum atom.
§4 A kísérleteket a Franck és Hertz
Az első és a harmadik Bohr posztulátumát kísérletileg igazolták kísérletei Franck és Hertz (német tudósok) 1913
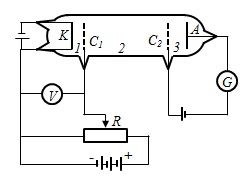
13 Pa) azt, amely egy katód (K), két rács (C1 és C2) és egy anód (A). Az elektronok által kibocsátott a katód gyorsítjuk egy potenciális különbség között alkalmazott R és C1. Között a rács C2 és egy kis retardáló potenciális alkalmazott 0,5 V. elektronok felgyorsulnak a régióban, ahol a tapasztalat ütközések higany atomjai. Az elektronok elég energiája az ütközés után, hogy felszámolja a késleltető potenciális 3. régió (a rajzon) eléri az anód. Amikor rugalmatlan ütközések elektronok higany atomok, az utóbbi lehet izgatott. Szerint a Bohr-elmélet, mind a higany atom lehet beszerezni csak egy bizonyos energia, így közelítve az egyik gerjesztett állapotok. (Alapállapot n = 1, izgatott - n = 2, 3, 4, ...) Tehát, ha az atomok léteznek stacionárius állapotban, az elektronok ütköznek higany atomjai, kell energiát megtakarítani diszkréten bizonyos részeit, egyenlő az energia különbség megfelelő helyhez államok.
A tapasztalat, hogy amikor a gyorsító potenciál emelkedett 4,86 a anódáram monoton növekszik. Miután a U = 4,86 maximális, az anód jelenlegi meredeken csökken. majd ismét növekszik, amikor a változó U = 4,86 ÷ 4,86 · 2 V. Ha U = 2 · 4,86 B csökken, majd ismét növekszik, stb
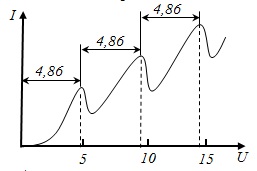
Mercury atom, majd az alapállapotba, fényt bocsátanak ki a λ = 255 nm (UV), amely megtalálható a kísérletben. Így a tapasztalat Frank és Hertz megerősítette az I. és a III-III Bohr tételezi.
§5 Spectrum hidrogénatom Bohr
Amikor egy elektron mozog olyan pályán Coulomb-erő centripetális. majd
Szerint II - th posztulátum Bohr
Bohr sugara az első pálya
A belső energia az atom az összege mozgási és helyzeti energia
Behelyettesítve a kifejezés az R, megkapjuk a megengedett energia értékeket:
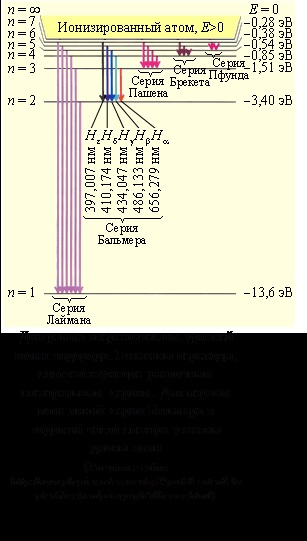
ahol a mínusz jel azt jelenti, hogy az elektron kötött állapotban. Tól (1) következik, hogy az energia Államok az atommal egy sor teljesítménynövelési szintek, hogy függ az n értéke. N egész szám a (1) meghatározzuk az energia szintjét az atom, az úgynevezett főkvantumszámú. Energia állapotban n = 1 jelentése az alapállapotba. Állam n> 1 hívják izgatott. A megfelelő energiaszinten az alapállapotba, az úgynevezett földön, az összes többi - izgatott.
Ionizációs atomok - elektron elkülönülés az atom. A ionizációs energia hidrogén 13,6 eV.
Szerint II - mu posztulálni bór a stacionárius állapotban, hogy stacionárius állapotban n m (n> m) halad a hidrogénatom kibocsát egy foton energiával
- képletű Balmer - Rydberg
ahol - a Rydberg állandó.
Bohr belsőleg ellentmondásos: alkalmazza a klasszikus fizika törvényei, de alapul kvantum kívánságot. Bohr nem tudja megmagyarázni a hélium spektrumát atom.