Sam feladat himiya_var_obschy
Összetételének meghatározására a reakcióelegy előtt és után a reakcióelegyet a reakció hozamát termékek.
Készíts egy anyagmérleg asztalra.
1. A kémiai reakció a tömegmérleg számítási
NH4CI + NaOH = nátrium-klorid + NH3

2. Jellemzői a törzsoldat
CM (NH4CI) = 4 mol / l; MP-RA (NH4CI) = 2,3 kg; (NH4 Cl) = 1,065 g / ml;
CH (NaOH) = 2 mol / l; MP-RA (NaOH) = 2,5 kg; (NaOH) = 1,250 g / ml;
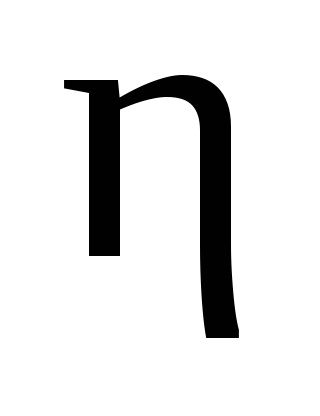
Döntetlen számítási anyagok jönnek reagáló
Döntetlen számítási anyagok a reakció során képződött (reakciótermékek) Áramlási sebesség:
A oldat térfogata jön NH4CI:
Száma NH4CI a bejövő oldatban:
Mass NH4CI a bejövő oldatban:
A víz tömege a bejövő ammónium-klorid oldatot NH4CI:
A kötet a bejövő alkáli-oldatot (NaOH):
NaOH anyag tömege a bejövő oldatban:
A szám a bejövő NaOH-oldat:
A víz tömege lúgos oldatban:
Száma NaOH reagáltatunk a kimenet a reakció termékek:
4. feladat. Határozza meg a közeg pH-ja a reakció után.
Befejeződése után a reakció anyagok oldatban jelen lévő: NH4CI, NaOH, nátrium-klorid, részlegesen oldott ammónia. Reakcióközeg hatással hidrolizáljuk nátrium-hidroxiddal és NH4CI.
mol / l, mivel, majd
A hidrogénionok koncentrációját által termelt hidrolízis NH4CI, és számítási az állandó hidrolízis foka:
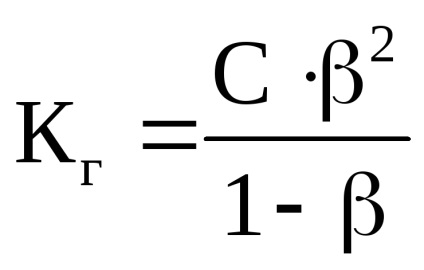
ahol C - a sókoncentrációt mol / l;

Mivel a hidrolízis foka lényegesen kisebb, mint egy, akkor a kifejezés válik:
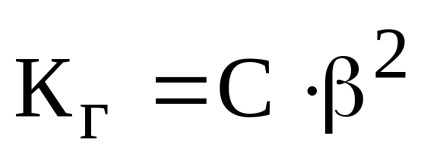
Állandó hidrolízise gyenge bázis és erős sav sói számítják az alábbi képlet szerint:
,
.
Mivel a C (HCI) = C (NH4CI), majd a
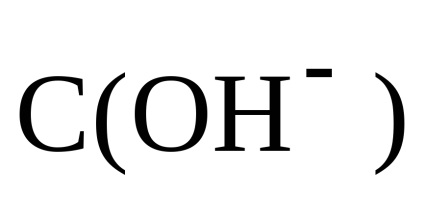
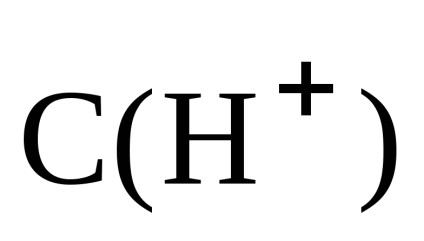
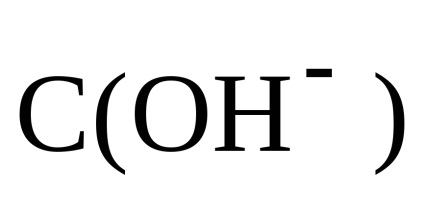
Következésképpen, a pH-ja az oldat alkáli-koncentrációja figyelembe:
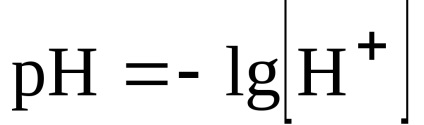
.
OPTIONS félévben JOB DLYAIISEMESTRA