nikkel vegyértéke (ni), és példák a általános képletű
Általános információk a oxidációs állapotú nikkel
Ni - tagja a negyedik csoport periodaVIII oldalán (B) a periódusos rendszer az alcsoport. Metal. Rendeltetése - Ni. Sorszám - 28.
Egy egyszerű anyag nikkel - fényes fehér fém ezüstös színű. A sűrűsége 8,91g / cm3 Olvadáspont 1455 ° C Forráspont 2900 ° C-on
Nikkel két allotropic módosításokat. Az alábbiakban a 250 o C α-rezisztens nikkel egy hatszögletű rács, a fenti 2500 C o - β-nikkel felületen középpontos köbös rács.
A vegyértéke nikkelt a vegyületek
Nikkel - huszonnyolcadik eleme a periódusos DI Mengyelejev. Ez a negyedik időszak VIIIV csoportban. A mag a nikkel atom tartalmazott 28 proton és 31 neutront (tömegszáma 59). A nikkel-atom négy energia szint, amely az elektronok 28 (ábra. 1).
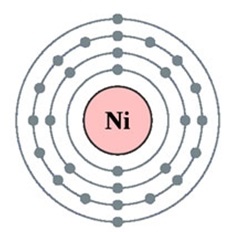
Ábra. 1. Szerkezet nikkel atom.
E általános képletű nikkel-atom az alapállapotú a következő:
És az energia diagramja (épített csak a külső elektron energia szinten, amely különbözőképpen hívják vegyérték):
A jelen két párosítatlan elektront azt jelzi, hogy a nikkel kiállítási vegyértékével vegyületek II (NiO, Ni (OH) 2. NiCl2. NiBr2). Ismeretes, hogy a nikkel is jellemzi vegyértékű III (Ni2 O3. NiOOH).
Példák problémák megoldása
Írja be a reakciókat, amelyek elvégzésére a következő transzformáció:
Az egyenletek a fellépő reakciók oldatban, felhívni ionos és ionos kondenzált formák.
Azáltal, hogy egy oldatot a nikkel-klorid (II) aktivitása nagyobb, mint a nikkel-fém, a nikkel nyerhető szabad formában (szubsztitúciós reakcióval):
Ni 2+ + Zn o → Ni o + Zn 2+.
Nikkel oldódik híg kénsavban képezve nikkel-szulfát (II):
Ni o + 2H + → Ni 2+ ++ H2.
nikkel-nitrát-(II) úgy állíthatjuk elő is cserereakció:
Ható nikkel-nitrát-(II) állíthatók elő alkálifém-hidroxiddal a nikkel (II):
Ni 2+ + 2OH - = Ni (OH) 2 ↓.
nikkel-kloridot (II) hidroxid nikkel (II) úgy állíthatjuk elő, sósavval semlegesítjük: