Tudományos Elektronikus Könyvtár
1.1. Víz fizikai tulajdonságait
Fizikai tulajdonságok teljesen meghatározott számos művet. Víz (H2O) - legegyszerűbb stabil kémiai vegyületet hidrogén és oxigén, színtelen folyadék, forráspontja 100 ° C-on A kémiai képlete egy ilyen egyszerű víz: H2O; H-O-H [1-8]. A méret egy molekula víz körülbelül 3 Å (Angström), illetve körülbelül 0,28 nm (nanométer).
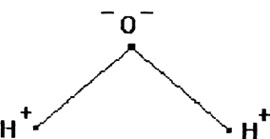
Ábra. 1. A szerkezet a program
vízmolekulák
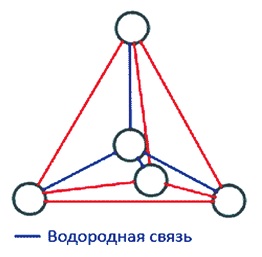
Ábra. 2. A tetraéderes szerkezete vízmolekula
Víz áll egy viszonylag nagy egy oxigénatomot és két hidrogénatom kis, amely körül forog felhő közös negatív töltésű elektronok (ábra. 1). Szög H-O-H molekulák H2O gáznemű és folyékony formában mozog 104,5-109 °
A jég a molekulákat köti össze hidrogénkötések. Ebben a tekintetben, mind a négy molekulák lokálisan rendezett egy tetraéderes szerkezet, négy közeli molekulák vannak elrendezve a csúcsok egy háromszög alakú piramis, a központ, amely az ötödik molekula
víz (ábra. 2).
A pozitív töltésű atommag oxigénatom, tekintettel a nagy tömeg és töltés, az erősebb vonzza az elektron felhő, így baring sejtmagok hidrogén.
Három atommagok vízmolekulák képeznek egyenlő szárú háromszög két hidrogénatom protonok és az oxigén az alján, hogy a felső. Távolsága O-H 0,9568 Å (0,1 nm); H-H - 1,54 Å (0,15 nm). Vízmolekula modell által javasolt Niels Bohr [9] ábrán látható. 3.
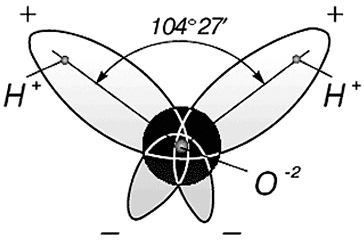
Ábra. 3. A szerkezet a vízmolekulák, a javasolt Bohr [9]:
és - közötti szög a H-H kötések;
b - a megjelenése az elektron felhő egy molekula víz
A víz tulajdonságai nagymértékben függ hidrogénkötések. Mivel a nagy különbség elektronegativitása hidrogénatomok és oxigén elektron felhők erősen eltolódik a oxigént. Emiatt, valamint, hogy a hidrogén-ion nincs belső elektrondonor réteg, és egy kis méretű, akkor behatol egy elektronikus borítékba negatívan polarizált szomszédos atomon molekula. Ennek köszönhetően, mindegyik oxigénatom vonzódik a hidrogénatomok más molekulák, és fordítva.
Minden vízmolekula részt tud venni egy legfeljebb négy hidrogénkötések, két hidrogénatom - minden egy, és oxigénatom - két; Ebben az állapotban a molekulák egy chip a jég. Olvadási linkek törött, amely lehetővé teszi a vízmolekulák csomag szigorúbban; melegítéssel víz csatlakozás továbbra elszakítani, és sűrűsége növekszik, de a feletti hőmérsékleten 4 ° C-on, ez a hatás gyengébb lesz. A lepárlása szakadás összes fennmaradó csatlakozásokat. Függetlenítés igényel sok energiát, így a magas hőmérséklet és a konkrét
hő olvadás- és forráspontja és a nagy hőtároló képessége. A víz viszkozitása által okozott, amelyek zavarják a hidrogénkötés vízmolekulák mozognak különböző sebességgel. A szerkezet a elektron felhő vízmolekulák olyan, hogy a jég minden molekula kapcsolódik négy hidrogénkötések a közeli molekulák hozzá, a koordinációs száma molekulák a jég struktúra négy. Körülbelül a méret a molekula lehet megítélni a nagysága közötti távolság a szomszédos molekulák a jég alkotó 2,67 Å (0,267 nm). Ennek megfelelően, a vízmolekula is tulajdonítható, hogy a sugara egyenlő 1,38 Å (0,138 nm). A dipólusmomentuma víz 1.87 Debye. Elektromos dipólmomentum - vektor fizikai mennyiség jellemző együtt összesen Az elektromos rendszer tulajdonságait a töltött részecskék (töltés eloszlása) abban az értelemben, hogy az általa előállított a területen, és intézkednek a külső területeken.
Tanulmányok kimutatták, hogy a víz megtartott proximális elrendelő szerkezetében rejlő jég. Következésképpen, a tendencia a vízmolekulák az egyes körül négy legközelebbi molekulák és a hidrogén kötések kialakulását velük járó mind folyékony, mind szilárd állapotban. A távolság a szomszédos molekulák olvadó jég változik 2,76 Å (0,276 nm), 2,90 Å (0,29 nm). Lényegi másodlagos helyen legközelebbi molekulák vezet nagyon laza, nyitott szerkezetű. Ez magyarázza a rendhagyó víz tulajdonságai.
Közel gömb alakú vízmolekula van egy Határozottan kifejezett polaritása, mint a elektromos töltéseket az elrendezés aszimmetrikus. Minden molekula egy miniatűr kétpólusú nagy dipólmomentum.
A polaritás a molekulák jelenlétében Ezeknek a részben kompenzálatlan elektromos töltést hoz létre molekulacsoportokból - társult. Teljes mértékben megfelel a képlete H 2 O csak vizet a gőz állapotban. A hőmérséklet-tartomány 0 és 100 ° C-koncentrációját az egyedi (monomer molekulák) folyékony víz nem haladja meg az 1%. Az összes többi vízmolekulák egyesítjük a társult különböző fokú komplexitás, és az összetételük által leírt általános képletű
[H 2 O] X. Az oka a kialakulásának a társult hidrogénatom kötések. Ezek között felmerülő atommagok hidrogén molekulák és néhány elektronikus „kondenzáció”, más oxigén atommagok vízmolekulák.
Az egyenetlen eloszlása elektromos töltések vezet az a tény, hogy a vízmolekula polarizált lesz kicsi mágnes.
A Föld mágneses tere, a vízmolekula folyékony állapotban, összegyűjtött néhány megoldás instabil hatására a vonzás ellentétes töltésű pólusok. A instabilitása az ilyen szerkezetek határozza meg, hogy gyenge hidrogénkötések között vízmolekulák, néha hidrogén hidak.
A tetraéderes alakja megismétli egyetlen molekula a kristályos szerkezetű jég. Esetleg szerepet játszik az, hogy a szög H-O-H molekula H2O majdnem ideális tetraéderes szög 109 °, és a vízmolekulák, mint tudjuk, egyesítjük útján hidrogénkötések amelyek pontosan abba az irányba O-H. Ezek a háromszög alakú piramis is kombinálhatók be néhány felépítmény. Egy ilyen komplex háromdimenziós jeges felépítmény a tetraéderek teljes egészére kiterjed mennyiség (ábra. 4).
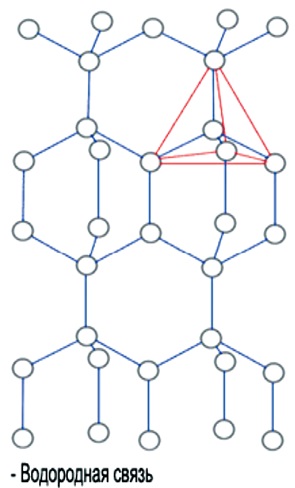
Ábra. 4. szerkezete jég H2O
Ldoobraznaya víz molekula mind egy egyszerű vízmolekula és klaszter ldoobraznyh struktúrák (ábra. 5).
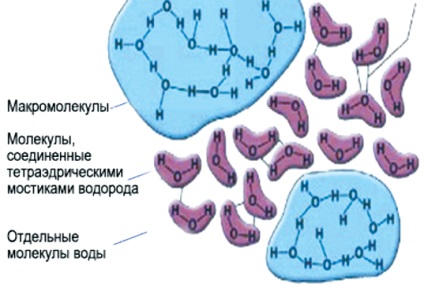
Ábra. 5. A víz szerkezete ldoobraznoy