cink formula Chemistry
Definíció és cink képletű
Egy egyszerű anyag a cink ezüstfehér fém kékes árnyalatú, de a nedves levegő, az fokozatosan fedezi oxid filmet, és elveszti fényét.
Szobahőmérsékleten, elég törékeny, de 100-150 ° C-on jó hajlíthatóság és lapokká hengereljük. Nagyon alacsony olvadáspontú fém. Sűrűség 7,1 g / cm 3 Olvadáspont 419,5 ° C, forráspontja 906 ° C-on

Ábra. 1. Cink. Megjelenés.
Cink Kémiai képlet
Kémiai megnevezése Cink - Zn a latin szó «Zincum». Ez a kémiai elem van elrendezve a negyedik időszak a periódusos rendszer IIB DI Mengyelejev. Arra utal, hogy a család elemei p. Metal. A relatív atomtömeg a cink 65,382 amu
Elektronikus cink formula
Ez tartalmaz 30 protont és 35 neutront a lényege a cink-atom (tömegszáma 65). A cink-atom négy energia szint, amely az elektronok 30 (ábra. 2).
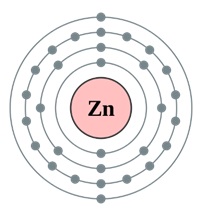
Ábra. 2. A szerkezet a cink-atom.
E általános képletű cink atomok alapállapotú a következő:
Példák problémák megoldása
Amikor teljes elégetése 6 g szerves anyagot alakult, 8,8 g szén-oxid (IV) és 3,6 g víz. Határozzuk meg a molekuláris képlete elégetett anyagot, ha ismeretes, hogy a moláris tömege 180 g / mol.
Felvázolt égési reakciója szerves vegyületek, amelyek megadott számú szénatomot tartalmazó, hidrogén és oxigén az «X», «y» és «Z», rendre:
Tömegének meghatározásához az elemek alkotják az anyag. Az értékek a relatív atomi tömegeket venni a periódusos D. Mengyelejev, egész számra kerekítve: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Kiszámítjuk a moláris tömege a szén-dioxid és víz. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol.
m (C) = [8,8 / 44] × 12 = 2,4 g;
m (H) = 2 × 3,6 / 18 × 1 = 0,4 g
m (O) = m (Cx Hy Oz) - m (C) - m (H) = 6 - 2,4-0,4 = 3,2 g
Definiáljuk a kémiai képlet szerinti vegyület:
x: y: z = m (C) / Ar (C). m (H) / Ar (H). m (O) / Ar (O);
x: y: z = 2,4 / 12 0,4 / 1 3.2 / 16;
x: y: z = 0,2. 0.4. 0,2 = 1: 2. 1.
Ezért legegyszerűbb képletű CH2 O vegyület és moláris tömege 30 g / mol [M (CH 2 O) = Ar (C) + 2 × Ar (H) + Ar (O) = 12 + 2 × 1 + 16 = 12 + 2 + 16 = 30 / mol].
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyületet kapunk igaz és moláris tömege:
Msubstance / M (CH 2 O) = 180/30 = 6.
Ezért az indexek szénatomok, hidrogént és oxigént kell akár 6-szor magasabb, azaz a anyagok képlet formájában fog a C6 H12 O6. Ez a glükóz vagy fruktóz.