A katalízis
CATALÍZIS (a görög katalízistől - megsemmisítés), a vegyi anyag sebességének változása. ha a c-c (katalizátorok) hatásának kitéve, amelyek részt vesznek az r-tionben, de nem részei a terméknek. A katalizátor nem sztöchiometrikus. kapcsolatokat a termékekkel és regenerálódik az egyes transzformációs ciklusok után. reagensek a termékekben. Megkülönböztetni a pozitív és a negatív K. között, attól függően, hogy a katalizátor felgyorsítja-e az r-tiont vagy lelassítja. A "K." kifejezés általában a p-ion gyorsulásának tulajdonítható; in-va, lassuló p-tion, az úgynevezett. inhibitorok. Katalitich. A p-ionra gyakorolt hatás a r-tion során képződött köztes periódus alatt állítható elő. in-va vagy termékek (lásd Autocatalysis), K. esetében jellemző, hogy kevés katalizátor felgyorsítja az átalakulást. nagyszámú bejövő reagálás. Így 1 tömeg% h) a Pt-katalizátor átalakulást okoz. 10 4 tömeg% h. SO3 SO2-ban vagy 10 6 tömeg% h. NH3 NO-ban. A gyorsító hatása p-erator CIÓ egy p-in-p rah általában nem tekintik K., azon az alapon, hogy a számos p-erator általában jelentősen meghaladja számú reagáló oldott-in. Azonban vannak ismert esetek, amikor a p -ionok gyorsulnak a jelenlétében. például az r-ritele nagyon kis adalékanyagai. a víz. A kem. a katalizátor összetétele és szerkezete a folyamat végén valószínűleg nem feltétlenül szolgál K-k kötelező jeleként. Ismeretes, hogy a vegyi anyag. a reaktorból kiszorított katalizátor összetétele lényegesen különbözik a betöltött katalizátoréktól; a katalizátor összetételét és szerkezetét befolyásolja a reakció összetétele. keveréket. A kem. a katalizátor összetétele és szerkezete értelemszerűen figyelembe vehető a komplex katalitikus folyamatok elemi szakaszaihoz képest. amelyben a katalizátor közvetlenül részt vesz, de erre szükség van megbízhatóan létrehozni a p-tion mechanizmust, ami nem mindig lehetséges. A "K." I. Berzelius bevezette 1835-ben. Homogén katalízisben a katalizátor és a reagáló anyagok molekulárisan diszperzív állapotban vannak ugyanabban a fázisban. Heterogén katalízis esetén a katalizátor önálló. fázis, amely a fázis interfészével van elválasztva, ahol a reagáló anyagok. Van egy heterogén homogén K is. Amelyen az r-tion egy szilárd katalizátor felületén kezdődik, majd folytatódik a térfogatban. Szokásos, hogy interphase catalysis-t neveznek két egymással nem elegyedő folyadék határán; a katalizátor szerepe a reaktánsoknak a fázisok közötti átviteléhez. Split. A homogén és heterogén K. közötti helyzet a folyadékfázisban kolloid részecskékkel mikroheterogén K-t foglal el. Gyorsulás p-tion jelenlétében. a micelle felületaktív anyagot nevezik. micelláris katalízis. Az élő szervezetekben zajló folyamatokban az enzimatikus katalízis kizárólagos szerepét az enzimek hatása okozza. Az ipar fontos eleme. A katalizátorok a promoterek, amelyeknek a katalizátor hozzáadásával kisszámú (százalék vagy százalékos frakciók) növelik aktivitását. szelektivitás vagy stabilitás. Ha a promotert nagy mennyiségben adjuk a katalizátorhoz, vagy maga katalitikusan aktív, összekeverjük. In-va, amelynek a katalizátorra gyakorolt hatása aktivitásának csökkenéséhez vagy a katalitikus aktivitás teljes megszüntetéséhez vezet. cselekvések, nevezett. a mérgek katalitikusak. Vannak olyan esetek, amikor bizonyos koncentrációkban a katalizátorral azonos adalékanyag és a t-rax promoter, míg másokban méreg. A heterog. K. széles körben használt hordozók, amelyek önmagukban katalitikusan inaktívak vagy inaktívak. A katalizátor alkalmazása számottevően növeli tevékenységét. Ch. arr. a katalizátor jelenlétének növekedése vagy a részecskék szintereléstől való meggátlása miatt (lásd Alkalmazott katalizátorok).
A katalízis általános alapelvei. Minden katalitikus. A p-ionok ön-származékos folyamatok, vagyis a rendszer Gibbs energiaveszteség irányába áramlanak. A katalizátor nem mozdítja el a vegyi anyag egyensúlyi helyzetét. R-tion, kivéve annak hatását az együtthatóra. a p-ra (vagy a volatilitási együttható, a p-ionok gázfázisban nagy nyomáson való reagálása esetén) c-e reakciójának aktivitása. Az egyensúly közelségében ugyanaz a katalizátor egyenlő mértékben gyorsítja az előremenő és a fordított p-iont, de messze nem lehet az egyensúlytól. Több. Lehetséges r-tion katalizátor felgyorsul, nem feltétlenül termodinamikailag naib. Előnyös, vagyis az egyik, amelynél a Gibbs energia vesztesége maximális. Például. jelenlétében. Bi2O3, MoO3 propilén részben oxidálódik (akrolein) jelenlétében. Co 3 O 4, teljes oxidációra kerül sor (CO 2 és H20 egészen). A katalizátor szelektivitásának (szelektivitásának) mérése az 1/2 O2 sebesség aránya. MO, 2) MO + H 2. M + H20. A K. egylépcsős folyamatait (más néven asszociatív vagy fúziós) a rendszer szerint végezzük: A + K. AK *. B + K. Ebben az esetben (a 2. ábrán a görbe), a katalizátor nem képez stabil időközöket. Conn. reagensekkel, de szerepel az aktivátorban. komplex AK *. A P-túllépés a rendszer kezdeti és végső állapotát, valamint nem katalitikus elválasztását lehetővé tevő potenciális gát megszüntetésével történik. p-tion, de csökkentett aktivációs energiával (E4 a 2. ábrán). Nagy sebességű katalizátor. r-tion m. b. Ez miatt nem csak csökkenti a aktiválási energia áramlását miatt p-CIÓ az új mechanizmus, de az a katalizátor hatására a lánc mechanizmus p-CIÓ. Például. katalitich. a vízgőz hatása a CO gázfázisú oxidációjára a reakciók kialakulásával magyarázható. a H és az OH aktív részecskéit tartalmazó láncok. Egy heterogén-homogén. K. abrancsok STI képződött aktív részecskéket (pl. Szabad. NO 2 gyökök és RO2 az oxidációs szénhidrogének RH), to- követően szétszóródik a gázfázisú, és továbbra is az áramkör.
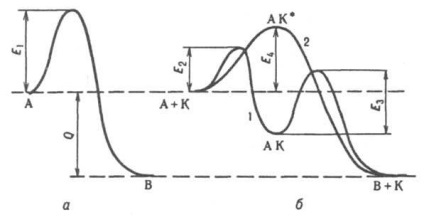
A. B típusú reakció energia diagramja; a - katalizátor nélkül, b - K katalizátorral; 1 - a lefektetési mechanizmus alatt 2 - a katalízis asszociatív mechanizmusa alatt: E1. E2, E4. E4 lehetséges korlátok, amelyek elválasztják a rendszer kezdeti és végső állapotát, Q - a p-tion termikus hatása.
A katalizátor felületén láncok kialakulása az olefinek polimerizációja és a CO és H2 szénhidrogének szintézise során bizonyították. más heterogén katalitikus. A p-láncok kimutatták a láncreakciókra jellemző tulajdonságokat: aktív központok létrehozását (a töltési helyek váltakozása a területen és felszabadulása), aktív intervallumok kialakulása. a szuper egyensúlyi koncentrációkban lévő részecskék (amelyek hozzájárulnak az energetikailag kedvezőtlen szakaszok akadályának leküzdéséhez), max. sebességű p-ion után, egy bizonyos idő után. Katalitich. és a lánc p-tions is összekapcsolja a kinetikus jelenséget. konjugáció. Ha átalakul. katalizátor kölcsönös. mivel a reagensek a leginkább katalitikusak. p-CIÓ (m. e. van egy közös köztitermék. egy bizonyos mennyiség vagy aktivált. komplex), lehetővé válik, hogy egy szuper egyensúlyi koncentrációja az aktív helyek az öntettel-sti katalizátor és mtsai. Effects tipikus lánc folyamatait.
A katalízis alapvető mechanizmusai. Katalitich. az elektronátvitel által okozott folyamatok (oxidáció, redukció, hidrogénezés, dehidrogénezés, instabil oxigéntartalmú vegyületek bomlása) redoxkatalizációnak nevezzük. Tipikus katalizátorok az átmenetifémek és vegyületjeik. Egyszerű oxidok (V2 O5. MnO2. MoO 3 Cr2 O 3), a spinell (Fe3 O4. CuCr2 O4), szulfidok (MoS2. WS2), stb.; a p-rán-sók és komplex szója p-tion esetében. átmeneti fémek. Magas katalitikus. Ezeknek az anyagoknak az aktivitását azzal magyarázza, hogy az átmenetifémek atomjai különböző fémekben létezhetnek. fokozatos oxidáció, amelynek megváltozása nem igényel nagy energiát. költségeket. Ennek eredményeképpen az elektron elektronból a reagensből a katalizátorba történő áthelyezése könnyebb, mint a redukálószer katalizátor jelenlétének hiánya az oxidálószerbe. Az egy elektron-átmenetben szabad hullám keletkezik. radikálisok, majd részt vesznek az r-tionban. Például. az egyik elektron áthelyezése a molibdén katalizátor aktív centrumából az oxigénhez, egy radikális ion O2 keletkezik, amely tovább vesz részt a katalitikus fázisban. oxidációval (Mo 5+ + O 2. Mo 6+ + O 2, O 2 + C n H m termék). Van egy oxidációcsökkentés. K. egy multielektron mechanizmussal, amelynél nincs szabad esés. a köztitermékként alkalmazott gyökök. részecskéket. A katalizátor és a reakcióképes molekulák közötti sok elektron-átmenet akkor lehetséges, ha a katalizátor több aktív helyén részt vesz. egy átmeneti fém atomjai. Például. a H 2 O 2 komplex vegyületek bomlása aktív. amely 2 Fe 3+ iont tartalmaz; a móló helyreállításában. nitrogén és N2H4 - komplex vegyületek. amely 2 vagy több V 2+ iont tartalmaz. A savas bázisos katalízis folyamata katalitikus. repedés. hidratáció, dehidráció. pl. p-izomerizáció, kondenzációs szerves vegyületek. in-ben. Tipikus katalizátorok a folyamatok ebbe a csoportjába tartoznak, amelyek képesek protonok átvitelére vagy kivétele a reagensektől, vagy pedig heterolitikussá. kölcsönhatást. reagensekkel (annyi elektron elválasztása nélkül). Ezek közül egy-egy - proton (. H2 SO4 CH3COOH, HF) vagy aprotikus (. BF3 AICI3) a-te, amorf és kristályos. alumínium-szilikátok. Al2O 3. Foszfátok, szulfátok. Az aktív központok közé tartoznak például a H + protonközpont (Brønsted központ) vagy az elektronpár akceptorja. atom Al (Lewis center). Kevésbé általánosan használták a főszerep katalizátorait (oldott bázisok, szilárd CaO, MgO stb.). Abban az esetben, az úgynevezett. multifunkcionális katalizátorok, a komplex katalizátor egyéni szakaszai. folyamatok, oxidáló-redukáló és savas bázisos folyamatok fordulnak elő egy többkomponensű többfázisú rendszer különböző komponenseiben. Például. a telítetlen aldehidek telítetlen oxidációjában telítetlen anyagok jelenlétében. oxid Mo és V az oxidációs elemi aktusban történik.-Újjáépítés. katalizátor átalakítások:
Kémiai enciklopédia. - M. Soviet Encyclopedia. Ed. I. L. Knunyants. 1988.