A formáció a fehérjemolekula - studopediya
Meghatározása Engels' Life is a létmódja hérjetestecskéiben „mostanáig, miután közel egy fél évszázad, nem vesztette el pontosságát és helytállóságát.
A lényege a test szerkezete olyan, és az egészet előforduló életében reakciók fehérjék. Bármilyen megsértése ezen fehérjék változásokat idézhet elő a jólét és az egészség. Annak szükségességét, hogy tanulmányozza a szerkezete, tulajdonságai és típusú fehérjék rejlik sokféleségét azok funkcióit.
Fehérjék alkotják a lényegét a kötőszövet - kollagén. elasztin. keratin. proteoglükánok.
Közvetlenül részt az építőiparban a membránok és citoszkeleton (integrál, és felszíni fehérjék poluintegralnye) - spektrin (felületes, eritrocita citoszkeleton bázikus protein), glikoforin (integrál, rögzíti a spektrin a felületen),
Ezt a funkciót, többek között részt vett a létrehozását sejtszervecskék - riboszómák.
Minden enzimek fehérjék. De ugyanakkor van kísérleti bizonyíték létezésére ribozimokból, azaz ribonukleinsav katalitikus aktivitású.
És harmonizálása anyagcsere szabályozásában a test sejtjeit különböző hormonok végzik. Néhány ezek közül a fehérjék, például az inzulin és a glukagon.
Ez a funkció az, hogy szelektíven kötődnek a hormonok, biológiailag aktív anyagok, és mediátorok a membrán felületén, vagy a sejteken belül.
Csak fehérjék az átadás foganatosítására anyagok a vérben. így például, lipoproteinek (transzfer zsír), a hemoglobin (oxigén szállítás), transzferrin (vas szállítás), vagy membránokon át - Na +, K + -ATP-áz (ellenkező transzmembrántranszportot a nátrium és a kálium-ionok), Ca 2+ -ATPáz (pumpáló ki a kalcium-ionok a sejtek).
Példaként a fehérje depó okozhat termelés és felhalmozódás az ovalbuminnal. Az állatokban és emberekben ilyen speciális Depot ott, de hosszan tartó éhezés izomfehérjék használunk, limfoid szervekben, hámszövet és a májban.
Számos intracelluláris fehérjék alakjának módosításához a sejt és a sejt vagy organellum mozgását (tubulin. Actin. Miozin).
Védő funkció fertőzések vérben immunglobulinok rendelkeznek, sérült szövet - a vér koagulációs fehérjék. Mechanikai védelmet és támogatást a sejtek végzik proteoglikánokból.
Fehérje - szekvenciát egymáshoz kapcsolt aminosavak peptidkötésekkel.
Könnyen elképzelhető, hogy a számos aminosav eltérhet legalább két bármeddig értéket. Biokémiai megállapodtak feltételezni, hogy ha a szám nem haladja meg a 10 aminosavból, a vegyület az úgynevezett peptid; ha a 10 és 40 aminosav - a polipeptid. Ha több, mint 40 aminosavat - fehérjét.
Lineáris fehérje molekula, amely, amikor aminosavakat a lánc vegyület egy elsődleges szerkezete. Képletesen lehet összehasonlítva a hagyományos izzószálas, amely navesheno több száz gyöngyök húsz különböző színű (a aminosavak számát).
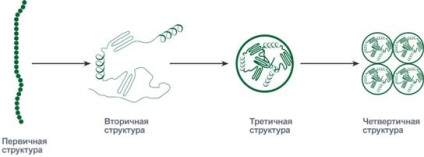
A szekvencia, és az arány az aminosavak az elsődleges szerkezetben a molekula határozza meg az ezt követő viselkedés: a képességét, hogy hajlítsa, szeres, vagy más formában kapcsolatot belül is. Forms molekulák során keletkező koaguláció, lehet egymás után kapnak szekunder, tercier és kvaterner szintű szervezet.
Sematikus ábrázolása a szekvencia
fehérje feltekeredés a negyedleges szerkezetének
Szintjén fehérje másodlagos szerkezet „gyöngyök” lehet tárolni egy spirális (hasonló az ajtó rugó), és egy összehajtogatott réteget. Ha a „gyöngyök” egymásra kígyó és a távoli része a gyöngyök vannak a közelben.
Stacking fehérje másodlagos szerkezetének simán végbemegy, hogy egy tercier struktúrát képezve. Ez az egyén gömböcskék, amelyben a fehérje tárolják kompakt formájában háromdimenziós tekercs.
Néhány fehérje gömböcskék vannak, és hatásukat nem egyedül, hanem a csoportok két, három vagy több darab. Az ilyen csoportok képeznek kvaterner fehérje szerkezetét.
Kombinációi aminosavak peptidkötésű létrehoz egy lineáris polipeptid-lánc, amely az úgynevezett elsődleges szerkezetét a fehérje.
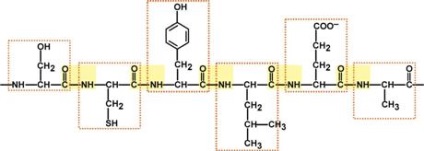
Része a fehérjének lánc hossza 6 aminosav (Ser-Cys-Tyr-Leu-Glu-Ala)
(Peptid kötések sárga színnel, aminosavak - a piros keret)
Az elsődleges szerkezet a fehérjék, azaz A aminosav szekvencia benne, programozott szekvencia nukleotid DNS. Veszteség, behelyezése, cseréje DNS nukleotidjainak változásához vezet az aminosav-összetételben, és ezáltal a szerkezet a szintetizált fehérje.
Ha a változás az aminosav-szekvencia nem végzetes jellegű, és az adaptív vagy legalább semleges, az új protein öröklött és továbbra is a populációban. Ennek eredményeként, vannak új fehérjék hasonló funkciókat. Ezt a jelenséget nevezzük polimorfizmus fehérjéket.
Például, a sarlósejtes vérszegénység, a hatodik helyen, # 946-lánc a hemoglobin helyettesítjük glutaminsav valinra. Ez szintéziséhez vezet a hemoglobin S (HBS) -, például a hemoglobin dezoxi amely polimerizálódik és kristályokat képez. Ennek eredményeként a vörösvérsejtek deformálódik szerezhet sarló alakú (banán), elvesztik rugalmasságukat, és a folyosón keresztül a hajszálerek összeomlása. Ez végső soron vezet, hogy csökken a szöveti oxigenizáció és nekrózis.
A szekvenciát és az aminosav arány az elsődleges szerkezete határozza meg a szekunder képző. tercier és kvaterner struktúrák.
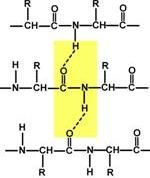
A másodlagos szerkezet a fehérje - a polipeptid-lánc ez egy módja szóló sokkal kompaktabb szerkezetet, amelyekben a kölcsönhatás a peptid csoportok hidrogénkötések közöttük. A formáció másodlagos szerkezet miatt a vágy, hogy elfogadja a konformáció a peptid a legmagasabb közötti csatlakozások száma a peptid csoportok. Típus másodlagos szerkezet függ a stabilitást a peptidkötés, a mobilitása közötti kommunikáció a központi szénatom a peptid-csoport, és a szén, a mérete egy aminosav-csoport.
Minden a fenti, párosulva az aminosavszekvenciát a későbbiekben vezet egy jól meghatározott konfigurációját a fehérje.
Két lehetséges másodlagos szerkezetek lehet megkülönböztetni: # 945; hélix (# 945;-szerkezetéből) és # 946; -skladchaty réteget (# 946;-szerkezetéből). Az egyik protein normálisan jelen van mind a struktúrák, de egy eltérő arány részesedést. A globuláris fehérjék érvényesül # 945; spirál, egy rostos - # 946; szerkezetéből.
Másodlagos szerkezet képződik csak a részvételével hidrogénkötések között peptid csoportok: az egyik csoport a oxigénatom reakcióba lép a hidrogén-atom a második, míg a második az oxigén peptid csoportot hidrogénatom kötődik az a harmadik, stb